
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
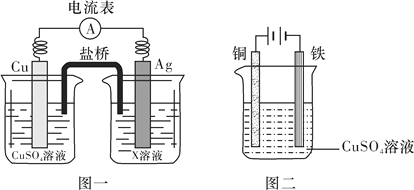
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
【答案】 CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 1 浅红色 -483.6 强 正反应 减小 未达到 AgNO3 Cu2++2e-===Cu
+OH- 1 浅红色 -483.6 强 正反应 减小 未达到 AgNO3 Cu2++2e-===Cu
【解析】(1)①Na2CO3是强碱弱酸盐,水解呈碱性:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;②硫酸属于二元强酸,所以0.05mol/L的硫酸中的氢离子浓度为:0.05
+OH-;②硫酸属于二元强酸,所以0.05mol/L的硫酸中的氢离子浓度为:0.05![]() 2=0.1mol/L,pH=1;③酚酞遇酸显无色,遇碱变红,用0.0100 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色,且半分钟内保持不变;(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,生成2 mol H2O(g)时放出483.6 kJ的热量,反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol;②已知:C(石墨,s)===C(金刚石,s) ΔH>0,由能量越低越稳定知,则稳定性石墨比金刚石强;(3)①可逆反应FeO(s)+CO(g)
2=0.1mol/L,pH=1;③酚酞遇酸显无色,遇碱变红,用0.0100 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为浅红色,且半分钟内保持不变;(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,生成2 mol H2O(g)时放出483.6 kJ的热量,反应的热化学方程式为:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol;②已知:C(石墨,s)===C(金刚石,s) ΔH>0,由能量越低越稳定知,则稳定性石墨比金刚石强;(3)①可逆反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g)达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;②反应FeO(s)+CO(g)
Fe(s)+CO2(g)达到平衡后,向容器中通入CO,反应物的浓度增大,化学平衡向正反应方向移动;②反应FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,Q=
Fe(s)+CO2(g) ΔH>0为吸热反应,若降低温度,平衡正向移动,平衡常数K增大;③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,Q=![]() 此时刻反应未达到平衡状态;(4)①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),溶液中银离子得电子产生银,故X溶液是AgNO3溶液;②图二装置在铁件上镀铜,铁作阴极,则阴极上铜离子得电子产生铜的电极反应式是Cu2++2e-===Cu。
此时刻反应未达到平衡状态;(4)①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),溶液中银离子得电子产生银,故X溶液是AgNO3溶液;②图二装置在铁件上镀铜,铁作阴极,则阴极上铜离子得电子产生铜的电极反应式是Cu2++2e-===Cu。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它可以按下列方法制备:
![]()
下列说法正确的是
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①②③中每生成或反应1mol Si,转移2mol电子
C. SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
D. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 加入铝粉有氢气产生的溶液中:Na+、K+、SO42-、Cl-、HCO3-
B. 含有大量硝酸根离子的溶液中:H+、Fe2+、SO42-、Cl-
C. 常温下,![]() =1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
=1×10-10的溶液中:NH4+、K+、Ca2+、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①~⑦在表中的位置,回答下列问题:
(1)①~⑦元素中原子半径最大的是__________(用元素符号表示);
(2)②⑦两种元素所形成的气态氢化物中最稳定的是__________(用化学式表示);
(3)⑤⑥两种元素最高价氧化物对应的水化物的酸性较强的是__________(用化学式表示);
(4)写出③④两种元素的最高价氧化物对应的水化物发生反应的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为____________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:___________,并设计实验方案验证该反应的产物:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为![]() ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式:![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 操 作 | 可能的现象 | 结 论 |
A | 向某溶液中先滴加少量氯水,再滴加KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
B | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和 Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:NaHCO3﹥Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com