

分析 (1)根据仪器图形可知收集气体的仪器为集气瓶;
(2)A、B、C、D收集气体分别为二氧化碳、氢气、氧气、二氧化碳,结合气体的密度判断收集方法;
(3)浓盐酸具有挥发性,混有氯化氢;
(4)乙炔密度比空气小,用向下排空法收集.
解答 解:(1)稀硫酸与氢氧化钠固体反应,生成的气体是二氧化碳,用集气瓶收集,故答案为:集气瓶;
(2)A中生成的气体是二氧化碳,不可用向下排空气法收集,所以图中收集方法不正确;B中锌粒与稀盐酸反应,生成的气体是氢气,应该用向下排空气法收集,所以收集的方法不正确;C中的双氧水和二氧化锰反应生成的气体是氧气,应该用向上排空气法收集,收集方法正确,反应方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:C;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)浓盐酸具有挥发性,生成的气体易混有氯化氢,故答案为:浓盐酸具有挥发性,会导致制取的气体不纯;
(4)乙炔密度比空气小,用向下排空法收集,可用A、D装置,乙炔燃烧的化学方程式为2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O,
故答案为:A和D;2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O.
点评 本题考查气体的制备实验,为高频考点,侧重于学生的分析、实验能力的考查,注意把握实验的原理以及物质的性质,难度不大.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸和醋酸反应时放出氢气一样多 | B. | 反应后醋酸溶液中锌粉有剩余 | ||
| C. | 稀释后溶液中的c(H+)硫酸比醋酸大 | D. | 反应开始时醋酸中的反应速率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为12 g | |
| B. | 体积为22.4 L | |
| C. | 二氧化碳分子个数约为6.02×1023个 | |
| D. | 氧原子个数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
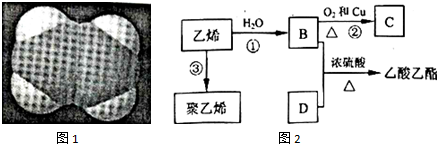
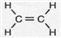 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI、H2、I2的浓度相等 | B. | HI、H2、I2的浓度不再发生变化 | ||
| C. | HI、H2、I2在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com