
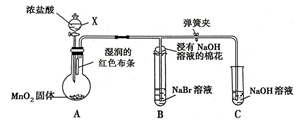
 如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)
如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)分析 (1)依据装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中,所以仪器X的名称是分漏斗;
(2)根据浓盐酸和二氧化锰的性质判断生成物,来书写反应方程式;浓盐酸中氯的化合价部分变、部分未部,所以盐酸体现酸性和还原性;
(3)氯气与湿润布条,氯气与水反应生成盐酸和次氯酸,次氯酸强氧化性、漂白性,所以湿润的红色布条褪色;
(4)装置B中有Br2生成,说明氯气与溴化钠中溴离子发生氧化还原反应,所以Cl2+2NaBr=2NaCl+Br2,根据氧化还原反应规律分析解答;
(5)使用NaOH溶液,防止氯气造成大气污染,吸收多余氯气.
解答 解:(1)依据装置图和实验目的分析判断,制备氯气是用固体二氧化锰和液体浓盐酸,固体在圆底烧瓶中,盐酸在分液漏斗中,所以仪器X的名称是分液漏斗,故答案为:分液漏斗;
(2)根据浓盐酸和二氧化锰反应生成氯化锰和氯气,所以反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;浓盐酸中氯的化合价部分变、部分未部,所以盐酸体现酸性和还原性,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;还原;酸;
(3)氯气与湿润布条,氯气与水反应生成盐酸和次氯酸,次氯酸强氧化性、漂白性,所以湿润的红色布条褪色,故答案为:褪色;HClO;
(4)装置B中有Br2生成,说明氯气与溴化钠中溴离子发生氧化还原反应,所以Cl2+2NaBr=2NaCl+Br2,说明Cl2的得电子能力强于Br2的得电子能力,故答案为:大于;
(5)使用NaOH溶液,防止氯气造成大气污染,吸收多余氯气,故答案为:吸收多余氯气,防止污染.
点评 本题考查了氯气的实验室制备,氯气的化学性质的应用,掌握氯气的化学性质是解答的关键,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
| 化合物 | 相对分子质量 | 密度/g/cm3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
 CH3COOCH2CH2CH2CH3+H2O.
CH3COOCH2CH2CH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
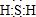 .
.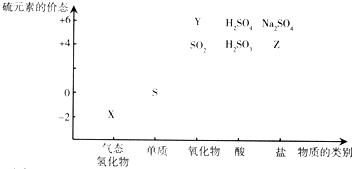
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
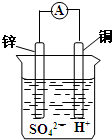
| A. | Zn2++2e-═Zn | B. | Zn-2e-═Zn2+ | C. | Cu-2e-═Cu2+ | D. | Cu2++2e-═Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
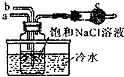 海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.
海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4 | B. | Na2O2 | C. | NH3•H2O | D. | NaClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2可以与KSCN溶液反应 | B. | (SCN)2可以与KI溶液反应 | ||
| C. | KSCN溶液可以与FeCl3溶液反应 | D. | (SCN)2可以与KBr溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com