
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
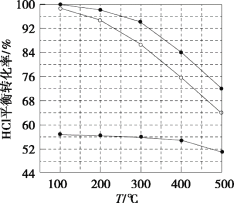
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00 mL 7.0 mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00 mL,用2.00 mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50 mL。
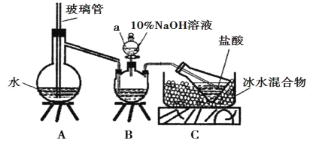
步骤二,氯的测定:准确称取橙黄色晶体w g,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是_________;
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在_____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将______(填“偏高”“偏低”或“无影响”);冰水混合物的作用是_______________。
(5)测定氯的过程中,使用棕色滴定管的原因是________
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1∶6∶3,其中氮元素以氨的形式存在。制备M的化学方程式为_____,其中双氧水的作用是____;制备M的过程中温度不能过高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工产品,在基础化学试验中,有着重要的作用。
(1)质量分数为98%(密度1.84 g/cm3)的浓硫酸在实验室中常用作吸水剂,其物质的量浓度为_________。
(2)若用上述质量分数为98%的硫酸,配制480 mL物质的量浓度为2.3 mol/L的硫酸,所需浓硫酸的体积为_________ mL。
(3)取用任意体积的浓硫酸时,下列物理量中不变的是_________。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
(4)完成(2)中实验除了烧杯、量筒、玻璃棒外,还需要的仪器有_________。
(5)下列操作使所配溶液的物质的量浓度偏高的_________(填序号)。
A.用量筒量取浓H2SO4,慢慢地沿着玻璃棒注入盛有50 mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中
B.往容量瓶转移溶液时,有少量液体溅出
C.未洗涤稀释浓H2SO4的小烧杯
D.定容时俯视
E.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸是一种绿色生态杀菌剂,结构简式为 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式![]()
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2![]() CH3COOOH+H2O
CH3COOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用于解释事实的离子方程式不正确的是( )
A.向AgCl悬浊液中加入Na2S溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq)![]() Ag2S(s)+2Cl-(aq)
Ag2S(s)+2Cl-(aq)
B.向酸性KMnO4溶液中加入NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是( )
A | B | C | D | |
实验 |
|
|
|
|
现象 | 一段时间后,a管液面高于b管液面 | 酸性KMnO4溶液褪色 | pH计测得①中pH大于②中pH | 试管①中有大量气泡,试管②中无现象 |
结论 | a管发生吸氧腐蚀,b管发生析氢腐蚀 | 有乙烯生成可以使酸性KMnO4溶液褪色 | 金属性:Mg>Al | 酸性:醋酸>碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如图:
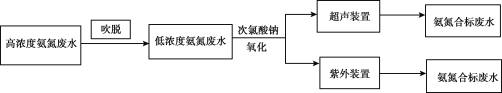
(1)吹脱法除氨氮:水中的氨氮大多数以NH4+和游离态的NH3保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移。从而达到脱除氨的目的。氨氮废水中NH3和NH4+平衡态的平衡关系有___。
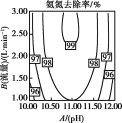
(2)温度、pH值、空气流量对脱除氨有很大的影响。pH值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,10<pH<11时,吹脱率随着pH增加而增加,请用化学平衡移动原理解释原因___。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是___。
II.对于含有H2PO4-的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生OH-,在通入O2的情况,又产生H2O2,以氧化水中的NH4+,同时NH4+还可以通过生成MgNH4PO46H2O沉淀而持续被除去。
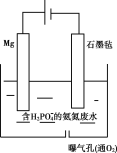
(1)阳极的电极反应式是___。
(2)废水中的NH4+'转化为MgNH4PO46H2O的离子方程式是___。
(3)pH大于10.5不利于MgNH4PO46H2O的生成,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应FeO(s)+CO(g) Fe(s)+CO2(g),700 ℃时平衡常数为0.68,900℃时平衡常数为0.46。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为:![]()
C. 增大CO2浓度,平衡常数增大
D. 该反应的正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com