
| A. | NaOH | B. | Na2O2 | C. | H2O | D. | CaCl2 |
分析 活泼金属和活泼金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,部分碱、大多数盐和金属氧化物、铵盐中含有离子键,据此分析解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A错误;
B.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故B正确;
C.水中只存在H-O极性共价键,没有离子键,故C错误;
D.氯化钙中钙离子和氯离子之间只存在离子键,故D错误;
故选B.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确二者概念区别是解本题关键,注意过氧化钠电子式的书写,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
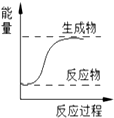
| A. | 金属钠与水的反应 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl (固体)混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥⅠA族元素的氢化物中,稳定性最好的沸点也最高 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+ | |
| B. | 该电池工作时,盐桥中K+向石墨电极定向移动 | |
| C. | 若用此电池电解饱和食盐水制取Cl2,当铜电极的质量减少6.4g时,产生氯气的体积为2.24 L | |
| D. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
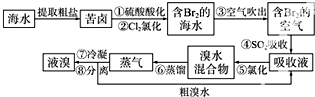
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
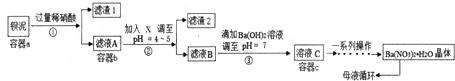
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者的质量数不同 | B. | 两者的中子数不同 | ||
| C. | 两者的核外电子数相同 | D. | 两者互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com