
A.反应体系的总压恒定 B.B的浓度不变
C.c(A)∶c(B)=1∶3 D.3v正(B)=2v逆(C)
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
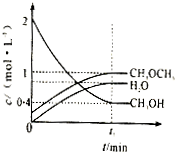 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学键 | C-H | O-H | H-H | C-O | C≡O |
| 键能/kJ.mol-1 | 413 | 463 | 436 | 358 | 1072 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 2 | 0.2 | 0 |
| 平衡浓度/mol.l-1 | 0.4 | 1 | 0.8 |
| 物质 | CH3OH (g) | CH3OCH3 (g) | H2O (g) |
| 起始浓度/mol.l-1 | 0.4 | 1.2 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省台州中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(8分)混合物平均摩尔质量通常可表示为: ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g) 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”), (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的平均相对分子质量 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高二上学期期末考试文科化学试卷(解析版) 题型:填空题
(1)已知工业上生产H2的过程中有如下反应: CO
(g) + H2O (g) CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g)
+ H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
|
浓度 物质 |
CO |
H2O |
CO2 |
H2 |
|
起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
|
平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。

①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
(8分)混合物平均摩尔质量通常可表示为: ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g) 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡
(填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡
(填“正向移动”、“逆向移动”、“不移动”),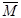 (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的平均相对分子质量 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com