
 1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.
1834年,德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物,得到了鱼法拉第所制液体相同的一种液体,并命名为苯.后来,法国化学家热拉尔等人又确定了苯的分子式为C6H6.分析 (1)根据化合物中元素的质量分数=$\frac{该元素的相对原子质量×原子个数}{化合物的相对分子质量}$×100%进行解答;依据与烷烃的质量分数比较说明是否饱和;
(2)苯甲酸与生石灰共热生成苯和碳酸钙;
(3)①根据仪器的作用判断,缺少温度计测热水的温度;
②苯与浓硝酸在催化剂条件下发生取代反应生成硝基苯和水;有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应;
③苯易挥发,长导管能导气及回流冷凝作用;根据硝基苯中混有酸,酸能与碱反应以及硝基苯不溶于水来分析;
(4)苯和足量氢气在一定条件下发生加成反应生成环己烷.
解答 解:(1)苯的分子式为C6H6,苯分子中碳元素的质量分数为$\frac{6×12}{6×12+6}$×100%=92.3%,根据烷烃的通式CnH2n+2可知,当n增大时,碳元素的质量分数逐渐增大,当n无穷大时,无限接近与$\frac{12n}{14n}$=$\frac{6}{7}$,表明苯是高度不饱烃,
故答案为:92.3%;不饱和;
(2)苯甲酸与生石灰共热生成苯和碳酸钙,该反应为:C6H5COOH+CaO→CaCO3+C6H6,
故答案为:CaCO3;C6H6;
(3)①需温度计插入热水中测热水的温度,故答案为:温度计;
②在催化剂的作用下,苯环上的氢原子硝基子所取代,生成硝基苯,同时有水生成:C6H6+HO-NO2(浓)$→_{55℃-60℃}^{浓H_{2}SO_{4}}$C6H5NO2+H2O,苯和硝酸反应,苯中的氢原子被硝基代替,所以是取代反应.
故答案为:C6H6+HO-NO2(浓)$→_{55℃-60℃}^{浓H_{2}SO_{4}}$C6H5NO2+H2O; 取代;
③苯易挥发,所以装置中长导管起冷凝回流作用,减少苯的挥发,让苯充分反应,要得到纯净的硝基苯,粗产品依次用蒸馏水、5%NaOH溶液洗涤、分液,再用蒸馏水洗涤、分液,最后用无水CaCl2干燥、蒸馏,从而得到纯硝基苯,
故答案为:冷凝回流,让苯充分反应;洗涤;分液;蒸馏;
(4)苯和足量氢气在一定条件下发生加成反应生成环己烷,反应的方程式为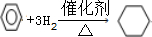 ,故答案为:环己烷.
,故答案为:环己烷.
点评 本题考查了苯的结构和性质,化学实验基本操作方法及物质的分离、除杂、化学方程式的书写,题目难度中等,抓住有机物的性质与物质的分离方法、明确苯的结构是解题的关键.


科目:高中化学 来源: 题型:解答题
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2nV | B. | $\frac{V}{11.2n}$ | C. | 22.4nV | D. | $\frac{n}{22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨都是由碳元素组成的,两者互为同位素 | |
| B. | 金刚石与石墨在足量的氧气中燃烧,所得产物相同,放出的热量也可能相等 | |
| C. | 金刚石比石墨稳定 | |
| D. | 1mol石墨比1mol金刚石的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 讲盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| B | 向某溶液中滴加氯水后,再加KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向饱和Na2CO3溶液中通入足量的CO2 | 溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| D | 向氯水中滴加紫色石蕊试剂 | 溶液变红 | 氯水显酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.
能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b=1:1 | |
| B. | Y为OH- | |
| C. | 氧化性为:SeO2>H2SO4(浓) | |
| D. | 若每生成0.2molX则该反应转移0.4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 除杂试剂 | 除杂方法 | |
| A | 乙烷(乙烯) | 氢气 | 加热 |
| B | 乙酸(乙醇) | 氢氧化钠溶液 | 蒸发 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴苯(苯) | 溴水 | 常温 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com