
分析 氨水中存在NH3•H2O?NH4++OH-,
(1)能使c(OH-)减小,使c(NH4+)增大,说明加入的物质含有NH4+或能和OH-反应;
(2)能使c(OH-)增大,使c(NH4+)减小,说明加入的物质能和NH4+反应或含有OH-;
(3)能使c(OH-)和c(NH4+)都减小,可以通过改变条件使平衡逆向移动但不能加入碱或铵盐,但可以加水稀释;
(4)能使c(OH-)和c(NH4+)都增大,可以采用升高温度或增大浓度方法.
解答 解:氨水中存在NH3•H2O?NH4++OH-,
(1)能使c(OH-)减小,使c(NH4+)增大,说明加入的物质含有NH4+或能和OH-反应,硫酸和氢氧根离子反应促进一水合氨电离,铝离子和氢氧根离子反应生成氢氧化铝程度而促进一水合氨电离,所以浓硫酸、硫酸铝能使c(OH-)减小,使c(NH4+)增大,故选CE;
(2)能使c(OH-)增大,使c(NH4+)减小,说明加入的物质能和NH4+反应或含有OH-,NaOH能电离出氢氧根离子而符合条件,故选D;
(3)能使c(OH-)和c(NH4+)都减小,可以通过改变条件使平衡逆向移动但不能加入碱或铵盐,但可以加水稀释,加水稀释促进一水合氨电离,但一水合氨电离增大程度小于溶液体积增大程度,所以c(OH-)和c(NH4+)都减小,故选B;
(4)能使c(OH-)和c(NH4+)都增大,可以采用升高温度或增大浓度方法,加入浓氨水,一水合氨浓度增大,一水合氨电离程度减小,但电离的物质的量多,所以c(OH-)和c(NH4+)都增大,故选A.
点评 本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,注意(3)(4)题:加水稀释促进一水合氨电离但c(OH-)和c(NH4+)都减小、一水合氨电离程度与其浓度成反比,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4(C2H4):酸性高锰酸钾溶液 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | B. | 由乙酸制乙酸乙酯 | ||
| C. | 乙烯使酸性高锰酸钾溶液褪色 | D. | 甲烷与氯气在光照条件下发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能使pH试纸变红色的溶液中:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用价层电子对互斥理论预测H2S和BF3的立体结构为:V形和平面三角形 | |
| B. | 分子晶体中一定存在分子间作用力,不一定存在共价键 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
在2L密闭 容器中,加入X和Y各4mol,一定条件下发生化学反应:
容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g) Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
A.5s时,正、逆反应速率都达到最大
B.前5s 内平均反应速率υ(Y)= 0.1 mol/( L·s)
内平均反应速率υ(Y)= 0.1 mol/( L·s)
C.达平衡时,各物质的浓度都保持不变,反应停止
D.升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
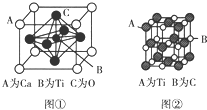 钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿课题之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
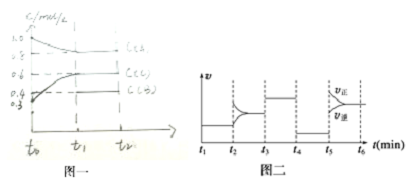
| A. | t4-t5阶段改变的条件为减小压强 | |
| B. | B的起始物质的量为1.0 mol | |
| C. | 在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡(与t1时刻浓度相同),a、b、c要满足的条件为a+$\frac{2c}{3}$=2.4和b+$\frac{c}{3}$=1.2 | |
| D. | 此温度下该反应的化学方程式为2A(g)+B(g)?2C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维和太阳能电池的主要材料都是二氧化硅 | |
| B. | 铵盐受热易分解,一定生成氨和相应的酸 | |
| C. | Cl2通入冷的消石灰中可制得漂白粉,漂白粉的有效成分是Ca(ClO)2 | |
| D. | 浓硝酸保存在棕色玻璃瓶中,烧碱溶液保存在无色带磨砂玻璃塞的玻璃瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com