
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【答案】C
【解析】
试题A、Ⅰ中由于稀硝酸有强的氧化性,与铁发生氧化还原反应,硝酸得到电子被还原变为NO,气体为无色,当遇到空气时,发生反应:2NO+O2=2NO2,气体变为红棕色的NO2,A正确;B、在Ⅱ中浓硝酸有强的氧化性,在室温下遇铁、铝会使金属表面氧化产生一层氧化物薄膜,对内层金属起保护作用,从而防止金属的进一步反应,即发生钝化现象,因此不能进一步反应,这恰好说明浓硝酸的氧化性比稀硝酸强,因此B正确;C、根据以上分析可知,C错误;D、Ⅲ中将金属铜放入浓硝酸中,Fe、Cu及浓硝酸构成原电池,由于铁在浓硝酸中发生发生钝化,因此铁为原电池的正极,铜为负极,失去电子被氧化变为Cu2+,在正极上溶液中的NO3-得到电子被还原为NO2气体,因此会看到有红棕色的气体产生。针对Ⅲ中现象,在Fe、Cu之间连接电流计,可根据电流计的指针偏转方向判断Fe是否被氧化,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】(1)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:__________________________。
(2)H2S燃烧生成的SO2与H2S进一步反应,硫元素转化为S2,写出反应的化学方程式:__________________________。
(3)在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应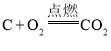 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 ![]() 部分生成物和反应条件略去
部分生成物和反应条件略去![]() 。下列推断不正确的是
。下列推断不正确的是![]()
![]()
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是![]()
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.在1个CsCl晶胞中含有1个Cs+
B.SO2在水中的溶解度比CO2在水中的溶解度要大
C.X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X
D.根据电子排布的特点,Cu和Ga在周期表中都属于d区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是生物油的主要成分之一,乙酸制氢具有重要意义:
热裂解反应CH3COOH(g)→2CO(g)+2H2(g) △H=+2l3.7KJ·mol-1
脱酸基反应CH3COOH(g)→CH4(g)+CO2(g) △H=-33.5KJ·mol-1
(1)请写出CO与H2甲烷化的热化学方程式_________________________________。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________(填“较大”或“常压”)。其中温度与气体产率的关系如图:
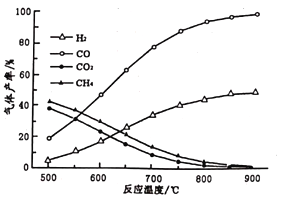
①约650℃之前,脱酸基反应活化能低速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高后,热裂解反应速率加快,同时______________________。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请用化学方程式表示:_________________________________。
(3)若利用合适的催化剂控制其他的副反应,温度为TK时达到平衡,总压强为PkPa,热裂解反应消耗乙酸20%,脱酸基反应消耗乙酸60%,乙酸体积分数为___________(计算结果保留l位小数);脱酸基反应的平衡常数Kp为___________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是

A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H> 0)
2NO2 △H> 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙,(b)甲>乙B.(a)甲>乙,(b)甲=乙
C.(a)甲>乙,(b)甲<乙D.(a)甲<乙,(b)甲>乙==
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com