
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) | |
| B. | c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| D. | Ka1(H2CO3)•Ka2(H2CO3)<Kw |
分析 A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.Ka1(H2CO3)•Ka2(H2CO3)=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$•$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$.
解答 解:A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)故A错误;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故B错误;
C.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故C错误;
D.Ka1(H2CO3)•Ka2(H2CO3)=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$•$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,碳酸和碳酸氢根离子都部分电离,所以$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$<c(H+),$\frac{c({H}^{+}).c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3)•Ka2(H2CO3)<KW,故D正确;
故选D.
点评 本题考查离子浓度大小比较,侧重考查学生分析判断能力,明确溶液中溶质及其性质是解本题关键,注意结合电荷守恒、物料守恒判断,易错选项是D,注意等量代换,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.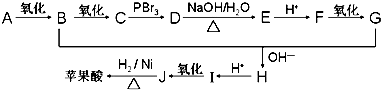


 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为14g | B. | 分子数为6.02×1023 | ||
| C. | 体积为11.2L | D. | 物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
下列实验可行的是
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com