
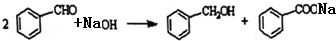
分析 Ⅰ、(1)根据可逆反应R-CHO+NaHSO3?R-CH(OH)-SO3Na,要想使CH3CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
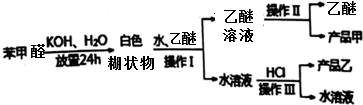
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答.
解答 解:Ⅰ、(1)因为可逆反应R-CHO+NaHSO3?R-CH(OH)-SO3Na,要想使CH3CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
故答案为:NaOH或HCl;蒸馏;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸;
(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,故答案为:萃取分液;
(3)根据以上分析,产品乙是苯甲酸,故答案为:苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α-羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛,
故答案为:取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛.
点评 本题考查有机物的分离提纯,为高频考点,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题

 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +352 | B. | +132 | C. | -120 | D. | -330 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  等质量锌粉与足量盐酸反应 | |
| B. | 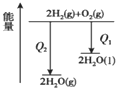 氢气与氧气反应中的能量变化 | |
| C. | 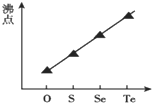 气态氢化物沸点 | |
| D. | 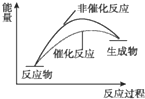 催化反应与非催化反应过程中的能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释时溶液中各离子浓度均减小 | |
| B. | 加强酸弱酸强碱弱碱均抑制盐类的水解 | |
| C. | 正盐水溶液的pH均为7 | |
| D. | 酸式盐的pH均小于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某研究小组利用下列反应制取水合肼(N2H2•H2O):CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:解答题
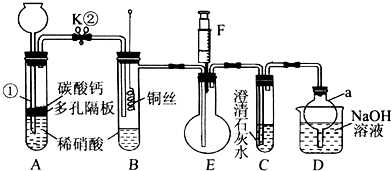
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com