
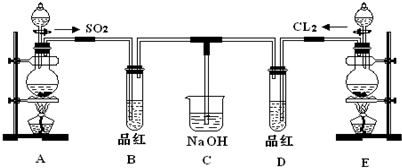
分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)实验室制备氯气发生的化学反应为MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,根据化学方程式书写离子方程式,根据化合价的变化计算转移的电子数目;
(3)二氧化硫和氯水都具有漂白性,但SO2的漂白具有可逆性,次氯酸的漂白不可逆,据此进行解答;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者发生反应Cl2+SO2+2H2O═2HCl+H2SO4.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗上方的活塞没有打开(或活塞上的凹槽没与瓶口上的小孔对齐);
(2)实验室用浓盐酸与二氧化锰反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)①SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,所以BD中均褪色,
故答案为:A;
②SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色,次氯酸的漂白不可逆,加热时,不能恢复红色,
故答案为:B中褪色的品红又恢复成红色,D中无明显现象;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,在水溶液中两者1:1发生反应:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都无漂白性,因而SO2和Cl2按1:1同时通入到品红溶液时,品红溶液并不退色,
故答案为:Cl2+SO2+2H2O═2HCl+H2SO4.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握氯水、二氧化硫的漂白性实质及区别,试题培养了学生的分析能力及化学实验能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.6g | B. | 15.2g | C. | 18.8g | D. | 21.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核 | B. | 原子 | ||
| C. | 胶体粒子 | D. | 悬浊液的分散质粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界硅元素的贮量丰富,并存在大量的单质硅 | |
| B. | 硅可由二氧化硅还原制得 | |
| C. | 二氧化硅晶体--水晶可用于制造光学仪器等 | |
| D. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
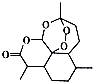
| A. | 属于芳香族化合物 | B. | 能存在于热的氢氧化钠溶液中 | ||
| C. | 易溶于氯仿等有机溶剂 | D. | 分子结构中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | W |
| A. | X、Y、Z、W中至少有一种是金属元素 | |
| B. | 元素的最高化合价:W>Z>Y | |
| C. | 简单离子半径由大到小的顺序:W>Z>Y>X | |
| D. | 一定条件下,W的单质可以置换出Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
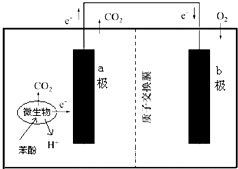
| A. | 该装置可将化学能转化为电能 | |
| B. | 溶液中H+由a极移向b极 | |
| C. | 电极b附近的pH降低 | |
| D. | 电极a附近发生的反应是:C6H6O-28e-+11H2O$\stackrel{微生物}{→}$6CO2+28H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com