
| A. | 玻璃钢和钢化玻璃成分不同,但都属于复合材料 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、Cl2都可用浓硫酸干燥 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
分析 A、玻璃钢是由玻璃与树脂混合成的,前者是无机非金属材料,后者是有机高分子合成材料,故玻璃钢是两种材料复合成的;钢化玻璃是普通玻璃高温熔融,急剧冷却得到,属于无机非金属材料;
B、氢氧化铁胶体为红褐色液体;
C、氢气、二氧化硫、氯气和浓硫酸不反应,可以做气体的干燥剂;
D、二氧化硅和氢氟酸反应是二氧化硅的特殊性质,两性氧化物是指和酸碱都反应的氧化物.
解答 解:A、玻璃钢是由玻璃与树脂混合成的,前者是无机非金属材料,后者是有机高分子合成材料,故玻璃钢是两种材料复合成的;钢化玻璃是普通玻璃高温熔融,急剧冷却得到,属于无机非金属材料,所以两者的成份不同,故A错误;
B、氢氧化铁胶体为红褐色液体,透明,能发生丁达尔现象,故B错误;
C、氢气、二氧化硫、氯气和浓硫酸不反应,可以做气体的干燥剂,H2、SO2、Cl2三种气体都可用浓硫酸干燥,故C正确;
D、二氧化硅和氢氟酸反应是二氧化硅的特殊性质,两性氧化物是指和酸碱都反应的氧化物,二氧化硅属于酸性氧化物,故D错误;
故选C.
点评 本题考查了物质性质分析,酸性氧化物概念理解应用,气体干燥的原理分析,掌握基础是关键,题目较简单.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
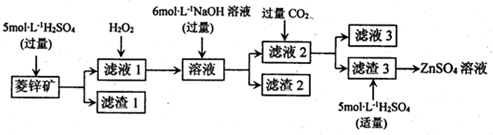
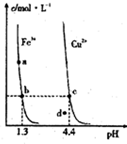 ②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.
②常温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH.金属阳离子浓度的变化如图所示,下列判断正确的是BC.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 向苯和苯酚混合溶液中滴加过量浓溴水 | 除去混合溶液中的苯酚 |
| B | 向待测液中加入饱和碳酸钠溶液 | 鉴别乙酸、乙酸乙酯、乙醇 |
| C | 向3mL5%CuSO4溶液中滴加3-4滴1%氢氧化钠溶液,再向其中加入0.5mL乙醛,加热 | 检验醛基 |
| D | 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液 | 检验溴乙烷中的溴元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O═2NaHCO3↓ | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| D. | 漂白粉溶液中加入醋酸:CH3COOH+ClO-═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种、3种 | B. | 3种、4种 | C. | 6种、2种 | D. | 2种、6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4gCO2、N2O成的混合气体中含有的质子数为2.2NA | |
| B. | 7.8gNa2O2中阴离子数目为0.2NA | |
| C. | 2L0.5mol•L-1(NH4)2SO4溶液中含有的NH4+离子数为2NA | |
| D. | 化学反应中每消耗1molO2,转移的电子数一定是4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com