
| A. | H2SO4和NaHSO4都属于酸 | B. | 火碱和纯碱都属于碱 | ||
| C. | KOH和NH3•H2O都属于电解质 | D. | Na2O和Na2O2都属于碱性氧化物 |
分析 A.水溶液中电离出的阳离子全部是氢离子的化合物为酸;
B.纯碱是碳酸钠的俗称;
C.酸碱盐都是电解质;
D.和酸反应生成盐和水的氧化物为碱性氧化物,反应过程中无元素化合价变化.
解答 解:A,H2SO4属于酸,NaHSO4都电离出的阳离子为氢离子和钠离子,是金属阳离子和酸根阴离子构成的盐,故A错误;
B.火碱是氢氧化钠的俗称是碱,纯碱是碳酸钠属于盐,故B错误;
C.KOH和NH3•H2O溶于水都可以电离出自由移动的离子,溶液导电,所以KOH和NH3•H2O都属于电解质,故C正确;
D.Na2O和酸反应生成盐和水属于碱性氧化物,Na2O2和酸反应生成盐、水和氧气,反应是氧化还原反应,所以过氧化钠不是碱性氧化物,故D错误;
故选C.
点评 本题考查了酸碱盐分类、电解质概念、物质组成和名称的判断等知识点,注意知识积累,题目较简单.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
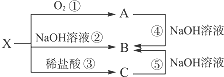 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素被氧化,碳元素被还原 | |
| B. | 当有1mol O2参与反应时,消耗$\frac{2}{3}$mol Fe | |
| C. | x=4,y=3 | |
| D. | 每生成1mol FeCO3,转移电子4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||||
| T | Q | W | G | |
| A. | 离子半径:T<W<G | |
| B. | 最简单气态氢化物的热稳定性:Q<R | |
| C. | 最高价氧化物对应水化物的酸性:Q>W>G | |
| D. | T和G组成的化合物甲溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油在上层,水在下层,汽油层呈无色 | |
| B. | 汽油在下层,水在上层,汽油层呈紫色 | |
| C. | 汽油在上层,水在下层,水层呈无色 | |
| D. | 汽油在上层,水在下层,水层呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
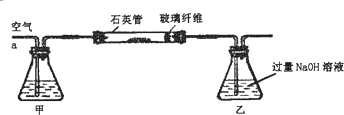
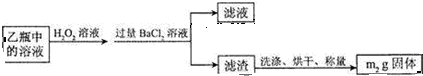
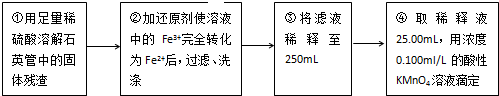
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9gH2O中含有电子数为NA | |
| B. | 11.2 LCl2中含有的原子数为NA | |
| C. | 常温常压下,48gO2和O3含有的氧原子数均为3NA | |
| D. | 标准状况下,11.2L CCl4所含的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com