
分析 Cu与一定量的浓硝酸作用,随着反应的进行,生成的气体颜色由深渐渐变浅,生成二氧化氮和一氧化氮的混合气体,用排水集气法收集,发生3NO2+H2O=2HNO3+NO,所以最后收集的气体为一氧化氮,根据得失电子守恒分析解答.
解答 解:Cu与一定量的浓硝酸作用,随着反应的进行,生成的气体颜色由深渐渐变浅,生成二氧化氮和一氧化氮的混合气体,用排水集气法收集,发生3NO2+H2O=2HNO3+NO,所以最后收集的气体为一氧化氮,根据得失电子守恒:2n(Cu)=3n(NO),所以n(NO)=$\frac{2}{3}$n(Cu)=$\frac{2}{3}$×$\frac{3.84g}{64g/mol}$=0.04mol,所以体在标准状况下的体积为0.04mol×22.4L/mol=0.896L=896mL,答:气体在标准状况下的体积为896毫升.
点评 本题考查化学方程式有关计算,难度中等,注意利用得失电子守恒进行计算,侧重考查学生的分析计算能力.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Q | 与L同族 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1mol/L氨水溶液与0.5mol/L氨水溶液中C(OH-)之比是2:1 | |
| B. | 0.1mol/LNH4Cl溶液中C(Cl-)=C(NH4+) | |
| C. | 向0.1mol/LNaNO3溶液中滴加稀盐酸,使溶液PH=5,此时混合液中C(Na+)=C(NO3-) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,使混合液的PH>7,此时混合液中C(CH3COOH)>C(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
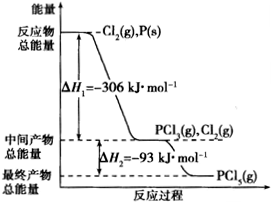 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com