
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是____________(填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)当产生0.1 mol Cl2时,转移电子的数目为_____________;
(3)ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以同质量的物质得到的电子数多少来衡量)是Cl2的______倍(结果小数点后保留两位)。
【答案】② 0.2NA 2.63
【解析】
(1)反应中盐酸表现为酸性和还原性;
(2)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量;
(3)1molCl2可以获得2mol电子,1molClO2可以获得电子5mol电子。
(1)在反应2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,HCl中Cl元素的化合价由-1价升高0,则HCl具有还原性,又该反应生成盐KCl,则表现盐酸的酸性,
故答案为:②;
(2)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,转移电子数为0.2NA;
(3)设质量都是71g,氯气得到的电子数为71g/71g·mol-1×2×1=2mol,ClO2得到的电子数为71g/67.5g·mol-1×1×5=71×5/67.5mol=![]() mol,则ClO2消毒的效率是Cl2的倍数为
mol,则ClO2消毒的效率是Cl2的倍数为![]() mol:2mol=71/27≈2.63,
mol:2mol=71/27≈2.63,
故答案为:2.63。


科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合后发生反应:SO2(g)+NO2(g) ![]() NO(g) +SO3(g)
NO(g) +SO3(g)
在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”); NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
(2)高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)===2NO(g)。估算自发进行的最低温度是__________℃。[已知该反应:ΔH=+180.50kJ/mol,ΔS=+247.7 J/(mol·K)]
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(4)用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为________________(用a、b、x表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
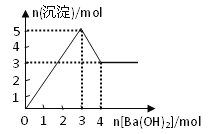
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B. 食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C. NaHCO3溶液中加少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D. 向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用下图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
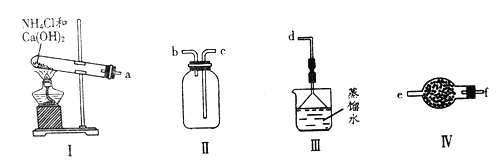
回答下列问题:
(1)写出利用装置I制取氨气的化学方程式_________________________________。
(2)按照气流方向,仪器连接的顺序:a→___________________________→d(用字母编号表示)。
(3)实验中装置III的作用________________。
(4)装置IV中仪器的名称为________,盛装的试剂为______________。
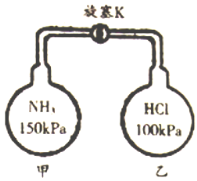
(5)在甲、乙玻璃容器中分别收集氨气和氯化氢,按下图装置进行实验。打开旋塞K,观察到的实验现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第________周期,该周期的元素种数是________;
(2)该元素处于元素周期表的第________族,该族的非金属元素种数是________;
(3)该元素处于元素周期表的________区,该区包括________族的元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com