
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
��1�� ��һ�������½�CO2 ��H2ת��Ϊ�״�������ˮ��������ط�Ӧ����
CO2(g) +H2(g)![]() CO(g)+H2O(g) ��H1=+41KJ/mol
CO(g)+H2O(g) ��H1=+41KJ/mol
CO(g) +2H2(g)![]() CH3OH(g) ��H2=-90KJ/mol
CH3OH(g) ��H2=-90KJ/mol
����CO2��H2ת��Ϊ�״�������ˮ�������Ȼ�ѧ����ʽΪ_____________________________________��
��2����һ���¶��£���2L�̶��ݻ����ܱ�������ͨ��2molCO2��3molH2��������ӦCO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H3<0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g) +H2O(g) ��H3<0�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
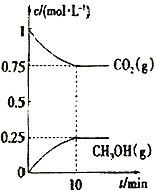
����˵���÷�Ӧ�Ѵ�ƽ��״̬����________________________��
A.��λʱ������3n molH-H�����ѣ�ͬʱ����2n mol O-H������
B.���������ܶȲ���ʱ��仯
C.��ϵ��n(CO2)/n(H2)=1��1���ұ��ֲ���
D. CO2����������ڻ�������б��ֲ���
�����д�ʩ��ʹn(CH3OH)/n(CO2)�������_______________��
A.�����¶� B.���º����£��ٳ���2molCO2��3molH2
C.ʹ�ø�Ч���� D.���º��ݳ���Heʹ��ϵѹǿ����
�ۼ�����¶��´˷�Ӧ��ƽ�ⳣ��K=_________������3λ��Ч���֣�����ʹK��ֵ��Ϊ1����Ӧ��ȡ�Ĵ�ʩ��___________________________��
A.����ѹǿ B.��ѹ����һ����H2 C. �����¶� D. �����¶�
��3����CO2��������Na2CO3��Һ����100mL 0.1mol/LNa2CO3��Һ��ȫ��0.44gCO2���壨��Һ����仯��������������Һ��c(HCO3-)+c(CO32-)+c(H2CO3)=________ mol/L
��4������Ϊ�ı�δ�������ʮ��Ƽ�֮һ��ȼ�ϵ����һ�����͵�����Ⱦ������������Ч�ʵ����������ͷ����豸�������Ʋ��ɵ�֮�Ƽ���������ҵ�͵�����ҵ��д���״�ȼ�ϵ�ؼ��Ե��������Ϊ���������ҺΪKOH ��Һ���ĸ����缫��Ӧ��___________________________________________��
���𰸡� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H=-49kJ/mol CD B 0.198 D 0.2 CH3OH-6e-+8OH-==CO32-+6H2O
CH3OH(g)+H2O(g) ��H=-49kJ/mol CD B 0.198 D 0.2 CH3OH-6e-+8OH-==CO32-+6H2O
����������1�� ��һ�������½�CO2 ��H2ת��Ϊ�״�������ˮ��������ط�Ӧ���� ��CO2(g) +H2(g)![]() CO(g)+H2O(g) ��H1=+41KJ/mol����CO(g) +2H2(g)
CO(g)+H2O(g) ��H1=+41KJ/mol����CO(g) +2H2(g)![]() CH3OH(g) ��H2=-90KJ/mol�����ݸ�˹���ɢ�+������CO2��H2ת��Ϊ�״�������ˮ�������Ȼ�ѧ����ʽΪCO2(g)+3H2(g)
CH3OH(g) ��H2=-90KJ/mol�����ݸ�˹���ɢ�+������CO2��H2ת��Ϊ�״�������ˮ�������Ȼ�ѧ����ʽΪCO2(g)+3H2(g)![]() CH3OH(g)+H2O (g) ��H=-49kJ/mol����2����A����λʱ������3n molH-H�����ѣ�ͬʱ��2n mol O-H�����ѣ�û��ָ����ˮ�е�O-H�����Ǽ״��е�O-H���������ж�ƽ�⣬��A��ѡ��B����������������ʼ�ղ��䣬���������ܶȲ���ʱ��仯�������ж�ƽ�⣬��B��ѡ��C����Ӧ�����ʼ����ͬ����ϵ��n��CO2��/n��H2��=1��1���ұ��ֲ��䣬����������������Ϊƽ��״̬����Cѡ��D��CO2����������ڻ�������б��ֲ��䣬����������������Ϊƽ��״̬����Dѡ����ѡCD����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����A��ѡ�����º����£��ٳ���2molCO2��3molH2���൱�������Сһ�룬ѹǿ����ƽ�������ƶ���ʹn��CH3OH��/n��CO2������Bѡ��C��ʹ�ø�Ч������ƽ�ⲻ�ƶ�����C��ѡ��D�����º��ݳ���He��g����ƽ�ⲻ�ƶ�����D��ѡ����ѡB���۽����ʼ����ͼ���֪��
CH3OH(g)+H2O (g) ��H=-49kJ/mol����2����A����λʱ������3n molH-H�����ѣ�ͬʱ��2n mol O-H�����ѣ�û��ָ����ˮ�е�O-H�����Ǽ״��е�O-H���������ж�ƽ�⣬��A��ѡ��B����������������ʼ�ղ��䣬���������ܶȲ���ʱ��仯�������ж�ƽ�⣬��B��ѡ��C����Ӧ�����ʼ����ͬ����ϵ��n��CO2��/n��H2��=1��1���ұ��ֲ��䣬����������������Ϊƽ��״̬����Cѡ��D��CO2����������ڻ�������б��ֲ��䣬����������������Ϊƽ��״̬����Dѡ����ѡCD����A���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�����A��ѡ�����º����£��ٳ���2molCO2��3molH2���൱�������Сһ�룬ѹǿ����ƽ�������ƶ���ʹn��CH3OH��/n��CO2������Bѡ��C��ʹ�ø�Ч������ƽ�ⲻ�ƶ�����C��ѡ��D�����º��ݳ���He��g����ƽ�ⲻ�ƶ�����D��ѡ����ѡB���۽����ʼ����ͼ���֪��
CO2(g)+3H2(g)![]() CH3OH(g)+H2O (g)
CH3OH(g)+H2O (g)
��ʼ 1 1.5 0 0
ת�� 0.25 0.75 0.25 0.25
ƽ�� 0.75 0.75 0.25 0.25
K=![]() =
=![]() ��0.198����ʹK��ֵ��Ϊ1��Ӧʹƽ�������ƶ�����K���¶��йأ��÷�ӦΪ���ȷ�Ӧ����ֻ�н����¶ȣ���ѡD����3��100mL0.1mol��L��1Na2CO3����Һ�����ʵ����ʵ���Ϊ0.1L��0.1mol��L��1=0.01mol��0.44gCO2CO2�����ʵ���Ϊ
��0.198����ʹK��ֵ��Ϊ1��Ӧʹƽ�������ƶ�����K���¶��йأ��÷�ӦΪ���ȷ�Ӧ����ֻ�н����¶ȣ���ѡD����3��100mL0.1mol��L��1Na2CO3����Һ�����ʵ����ʵ���Ϊ0.1L��0.1mol��L��1=0.01mol��0.44gCO2CO2�����ʵ���Ϊ![]() =0.01mol��������ӦNa2CO3+CO2+H2O=2NaHCO3������ǡ�÷�Ӧ����0.02mol��NaHCO3���������غ��֪��c��HCO3����+c��CO32����+c��H2CO3��=c��Na����=
=0.01mol��������ӦNa2CO3+CO2+H2O=2NaHCO3������ǡ�÷�Ӧ����0.02mol��NaHCO3���������غ��֪��c��HCO3����+c��CO32����+c��H2CO3��=c��Na����=![]() =0.2mol��L��1��
=0.2mol��L��1��
��4���ڼ״�ȼ�ϵ���У���������ȼ�ϼ״�����ʧ���ӵ�������Ӧ���ڼ��Ի����£��缫��ӦΪ2CH4O+16OH��-12e��=2CO32��+12H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���Ӧ2SO2+ O2![]() 2SO3���ﵽƽ��ʱ��n(SO2��:n(O2��:n(SO3���� 2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2����0.8mol��n(SO3����1.4mol����ʱSO2�����ʵ���Ӧ��
2SO3���ﵽƽ��ʱ��n(SO2��:n(O2��:n(SO3���� 2:3:4����С�������Ӧ�ٴδﵽƽ��ʱ��n(O2����0.8mol��n(SO3����1.4mol����ʱSO2�����ʵ���Ӧ��
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ASES��˾��Ƶ�����������DZͧ��Һ����Һ��ȼ�ϵ��ʾ��ͼ��ͼ��ʾ���й�˵����ȷ���ǣ� �� 
A.�缫2����������Ӧ
B.��ع���ʱ��Na+���ƶ�
C.�����ɵ缫1�����·����缫2
D.�缫1�����ĵ缫��ӦΪ��2NH3+6OH����6e��=N2��+6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯�����ת����ʵ�ʹ�ҵ�����������о�����Ҫ�����塣
��1����֪��ҵ�Ϻϳɰ�N2(g)+3H2(g)![]() 2NH3(g)�������仯��ͼ��ʾ����һ���¶��£���2 L�ĺ����ܱ�������Ͷ��2.2 mol N2��2.6 mol H2����10 min�ﵽƽ�⣬�����������ʾ��ƽ������Ϊ0.03mol��L-1��min-1
2NH3(g)�������仯��ͼ��ʾ����һ���¶��£���2 L�ĺ����ܱ�������Ͷ��2.2 mol N2��2.6 mol H2����10 min�ﵽƽ�⣬�����������ʾ��ƽ������Ϊ0.03mol��L-1��min-1
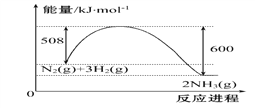
�ٸ÷�Ӧ����ЧӦ��H=______________
�ڷ�Ӧ�ﵽƽ���ų�������Ϊ__________kJ����ʱN2��ת����Ϊ___________���ڸ��¶��£���Ӧ��ƽ�ⳣ��K=__________
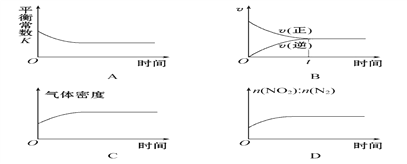
��2�����ó��ȵĻ���̿���Դ���NO2����Ӧԭ��Ϊ2C(s)+2NO2(g)![]() 2CO2(g)+N2(g)��һ���¶��£���һ�����Ļ���̿��NO2����һ�����ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________(�����)��
2CO2(g)+N2(g)��һ���¶��£���һ�����Ļ���̿��NO2����һ�����ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����Ȼ�ѧ����ʽ�У���ѧ��Ӧ�ġ�Hǰ�ߴ��ں��ߵ��ǣ� �� ��C��s��+O2��g���TCO2��g������H1 C��s��+ ![]() O2��g���TCO��g������H2
O2��g���TCO��g������H2
��S��s��+O2��g���TSO2��g������H3 S��g��+O2��g���TSO2��g������H4
��H2��g��+ ![]() O2��g���TH2O��l������H5 2H2��g��+O2��g���T2H2O��l������H6
O2��g���TH2O��l������H5 2H2��g��+O2��g���T2H2O��l������H6
��CaCO3��s���TCaO��s��+CO2��g������H7 CaO��s��+H2O��l���TCa��OH��2��s������H8 ��
A.��
B.��
C.�ڢۢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ϩ�����Ȼ�̼���ױ��ķ����ǣ� ��
A.���Ը������
B.��ˮ
C.Һ��
D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ʾø�ʹ����ı仯ѧ��Ӧ���ʵ�ԭ��,ͼ2��ʾ�������Ƽ�����ʼ��Ӧ���ʵ�Ӱ�졣ø�����Ƽ�����ø��ϲ�����ø���Եķ��ӡ����������Ƽ�����ᄎ��ø�Ļ��Բ�λ,�Ǿ��������Ƽ���ø���Բ�λ���������λ����,�Ӷ�����ø�Ļ��ԡ���ش��������⡣
 ͼ1
ͼ1 ͼ2
ͼ2
(1)��ͼ1��֪,��ø���͵Ļ����______(��ͼ����ĸ��ʾ),�����������______________________,�����Ч�ʸ��ߡ�
(2)��ϸ������ø�ij�����________,��Ҫ��ԭ����________��
(3)ͼ2�ж�������____���ߵĽ��,����bΪ����_____���Ƽ�������,�ж�������_________________������ͼ2�л��������ø�ļ���������ߡ�________________
(4)�ź��ļ�˵��Ϊ,������ڵ���mRNA�ڷ���ʱ���Ⱥϳɵ���Nĩ�˴�����ˮ������л����ź���,����������Ĥ�ϵ�����ʶ����֮���ϡ��ź��ľ���Ĥ�е������γɵĿ�������������ǻ,��������ת���߶�����ӹ�ʱȴû���˸��ź������С��ݴ����ǿ����ƶ��������п��ܴ��ڵ�ø��������_______________��
(5)�ܵĺ�ϸ���ϳ�ø����Ҫ��ATP��Ҫ��_______(����)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش�����˵������ȷ���ǣ�������
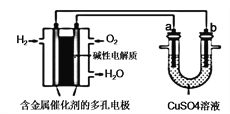
A. ��װ�����ڵ��ͭʱ�����һ��ʱ�䣬����������ͭ��Һ��Ũ�Ȳ���
B. ��aΪ��ͭ��bΪ��ͭ����װ�ÿ����ڴ�ͭ�ĵ�⾫��
C. ȼ�ϵ���и�����ӦΪ2H2��4e����4OH�� = 4H2O
D. ����װ���ڹ���������Cu2+ ��a�缫�ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com