
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
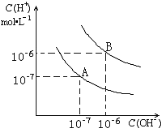
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________,c(H+)=__________
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
【答案】A 1×1012 1×10-6mol/L 10∶1 pH1+pH2=14或a+b=14
【解析】
(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6mol/L,Kw=c(H+)c(OH-)=10-12;水的电离是吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线;
答案为:A。
(2)由图像可知,95℃时,水中氢离子的浓度为1×10-6mol/L,氢氧根离子的浓度为1×10-6mol/L,则Kw=1×10-12;
答案为:1×10-12;1×10-6mol/L
(3)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)·10-5mol·L-1=V(H2SO4)·10-4mol·L-1,得V(NaOH):V(H2SO4)=10:1;
答案为:10:1;
(4)强酸的pH1=a,强碱的pH2=b,由95℃时,若100体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(OH-)=n(H+),则100×10-a=1×10b-12,102-a=10b-12,即2-a=b-12,则a+b=14或pH1+pH2=14;
答案为:pH1+pH2=14或a+b=14;


科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了测定某品牌铝合金中铝的含量,现设计了如下实验:
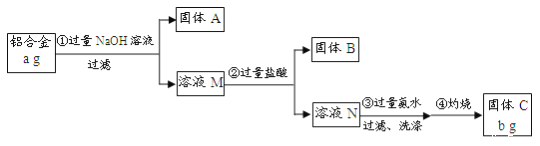
已知:该铝合金的主要成分为Al2O3、MgO、CuO、SiO2;2NaOH+SiO2=Na2SiO3+H2O;Na2SiO3+
2HCl=2NaCl+H2SiO3↓。
请回答下列问题:
(1)固体A的成分是_______;
(2)步骤③中生成沉淀的离子方程式为_____;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为______;
(4)该样品中铝的质量分数是______。(用a、b表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组推测,某无色溶液中可能含有以下离子:K+、Al3+、Mg2+、Cu2+、NH4+、Cl-、CO32-、SO42-,进行如下实验:
①取适量该溶液,加入过量NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,并得到澄清溶液。
②在①所得溶液中通入过量CO2,生成白色沉淀。
③另取原溶液于试管中,加足量BaCl2溶液后,得白色沉淀,再加稀盐酸,沉淀不溶解。
根据上述实验回答:
(1)写出①中反应生成气体的离子方程式_______________________________。
(2)该溶液中一定存在的离子有_____________,不能确定是否存在的离子有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于下图装置的说法正确的是

A. 若断开K1关闭K2,X、Y均为石墨,Z是NaCl溶液,则X 附近能得到氢氧化钠
B. 若断开K1关闭K2,X是纯铜,Y是粗铜,Z是CuSO4溶液,则该装置可用于铜的精炼
C. 若断开K2关闭K1,X是Cu,Y是Fe,Z是含有空气的海水,则该装置可用于保护Fe
D. 若断开K2关闭K1,X是Cu,Y是Zn,Z是稀H2SO4,则在X极有气泡生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023B.物质的量为 0.1 mol
C.体积约为 4.48 LD.氢原子的物质的量为 0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁和铜的固体混合物在空气中部分生锈(锈的成分为 CuO 和 Fe2O3),其总质量为 6.4 g,某实验小组对此固体混合物进行实验探究。

(1)操作 1 的名称为_____,此操作使用的玻璃仪器有_____、_____、_____。
(2)固体混合物中两种氧化物与稀硫酸反应的离子方程式为_____、_____。
(3)红色固体滤渣为_____(填“铜”或“氧化铁”)。
(4)查阅资料知 Cu+Fe2(SO4)3![]() CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
CuSO4+2FeSO4,说明在浅绿色强酸性溶液中___________ (填“含”或“不含”)Fe2(SO4)3。
(5)“一系列操作”中,其中有一步反应如下,请将此反应方程式配平:
_____Fe(OH)2+_________O2+_____H2O![]() _____Fe(OH)3
_____Fe(OH)3
(6)通过进一步实验得出:浅绿色溶液中不含 Cu2+,则原部分生锈的固体混合物中氧元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁储量居世界首位。用含Fe2O3的钛铁矿(主要成分为FeTiO3)制备TiO2流程如下:

已知反应TiO2++2H2O![]() H2TiO3+2H+ ΔH<0
H2TiO3+2H+ ΔH<0
(1)步骤①加Fe的目的是___________________________________(用离子方程式表达);步骤②冷却的目的是_________________________________________________________。
(2)上述制备TiO2的过程中,可以利用的副产物是__________________;考虑成本和废物综合利用因素,废液中应加入______处理;在“水浸”步骤中加入大量的水即可获得H2TiO3沉淀,请用相关化学原理解释___________________________________________________。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的步骤为
![]() ―→
―→![]()
![]()
![]()
反应TiCl4+2Mg===2MgCl2+Ti在Ar气氛中进行的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5.6g铁粉投入到盛有100mL2molL-1稀硫酸的烧杯中,2min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是( )
A. v(H2SO4)=0.5mol (Lmin)-1B. v(H2SO4)=1 mol (Lmin)-1
C. v(Fe)=0.5mol (Lmin)-1D. v(FeSO4)=1mol (Lmin)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
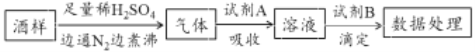
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com