
分析 (1)依据n=$\frac{m}{M}$=CV计算解答;
①依据溶液均一性解答;
②硫酸钠溶液中,C(Na+)=2C(Na2SO4)=2C(SO42-),依据溶液稀释过程中溶质的物质的量不变计算解答;
依据Ba2++SO42-=BaSO4↓,计算需要氯化钡物质的量;
(2)分别计算出两溶液中含有硫酸的物质的量、质量,然后根据V=$\frac{m}{ρ}$计算出混合液的体积,最后根据c=$\frac{n}{V}$计算出混合后稀H2SO4的物质的量的浓度.
解答 解:(1)14.2g无水硫酸钠配制成250mL溶液,其物质的量的浓度为$\frac{\frac{14.2g}{142g/mol}}{0.25L}$=0.4mol/L;
故答案为:0.4;
①溶液具有均一性,浓度与所取溶液体积无关,所以若从中取出10mL,其物质的量的浓度为0.4mol/L;
故答案为:0.4;
②硫酸钠溶液物质的量浓度0.4mol/L,则钠离子浓度为0.8mol/L,若将这10mL溶液用水稀释到100mL,依据溶液稀释过程中溶质的物质的量不变得:0.8mol/L×10mL=C(Na+)×100mL,解得C(Na+)=0.08mol/L;
10mL1mol/L硫酸钠溶液,含有硫酸根离子物质的量为:0.01L×0.4mol/L=0.004mol,依据方程式:Ba2++SO42-=BaSO4↓,要使硫酸根离子完全沉淀需要氯化钡物质的量:0.004mol,需要加入0.1mol/L的BaCl2溶液体积=$\frac{0.004mol}{0.1L}$=0.04L,即40mL;
故答案为:0.08;40;
(2)解:400 mL 0.8 mol•L-1 H2SO4溶液中含有硫酸的物质的量为:n(H2SO4)=0.8 mol•L-1×0.4 L=0.32 mol,
200 mL 98%浓H2SO4中的硫酸的物质的量为:n(H2SO4)=$\frac{1.84g•cm{\;}^{-3}×200mL×98%}{98g/mol}$=3.68 mol,
混合后溶液总体积为:V=$\frac{1.08g/c{m}^{3}×400mL+1.84g/cm{\;}^{-3}×200mL}{1.2×1{0}^{3}g•L{\;}^{-1}}$=$\frac{2}{3}$L,
所以稀释后c(H2SO4)=$\frac{0.32mol+3.68mol}{\frac{2L}{3}}$=6mol/L,
故答案为:6.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题有利于培养学生的分析能力及化学计算能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:解答题
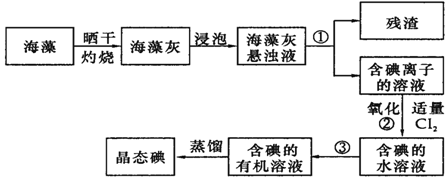
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=1.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
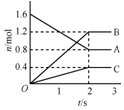 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com