
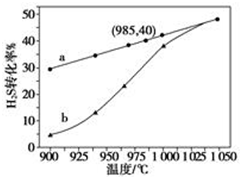
 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短. 分析 K为生成物浓度幂之积与反应物浓度幂之积的比;温度的升高,曲线b向曲线a逼近,反应速率加快,据此进行解答.
解答 以H2S起始浓度均为cmol•L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
2H2S(g)?2H2(g)+S2(g),
开始 c 0 0
转化0.4c 0.4c 0.2c
平衡0.6c 0.4c 0.2c
K=$\frac{0.2c×(0.4c)^{2}}{({0.6c)}^{2}}$=$\frac{0.8c}{9}$;
温度的升高,曲线b向曲线a逼近,反应速率加快,所以达到平衡时的时间缩短,
故答案为:$\frac{0.8c}{9}$;温度升高,反应速率加快,达到平衡所需的时间缩短.
点评 本题考查了化学平衡及其影响,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学计算中的应用方法,试题培养了学生分析能力及化学计算能力.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:多选题
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ω=4;⑤
Ω=4;⑤ Ω=2;⑥
Ω=2;⑥ Ω=4.
Ω=4.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
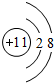 .
.| 实验编号 | X物质的量浓度(mol•L-1) | Y物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
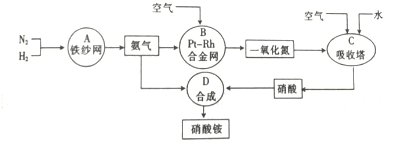
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
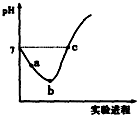 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| C. | 由a点到b点的过程中,溶液中C(H+):C(ClO-)减小 | |
| D. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 高分子材料可能导电,如聚乙炔 | |
| C. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| D. | 人造刚玉的主要成分是MgO,熔点很高,可用作高级耐火材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com