
����Ŀ���������ʮ�־�Ŀ���DZ����������ԴӺ�ˮ�л�ö������ʡ�
��1�����辭����ѧ�仯���ܴӺ�ˮ�л�õ�һ��������________________________
��2��������������ʣ���Ũ����ˮ�к��д�����Mg2+,������ȡ����þ���������£�

�ٱ��ǵ���Ҫ�ɷ���CaCO3��ȼ�ձ���ʱ������Ӧ�Ļ�ѧ����ʽ��____________________________���ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��________________________��
�ڹ��˺���Mg(OH)2�м���________________���õ�MgCl2��Һ���ھ���һϵ�в����õ�MgCl2��
�۵������MgCl2�õ�þ������ͬʱ����___________ ________________�������������������е�_____________________________���裬�������ĺô���__________________________,þ������ȴ��Ϊ����þ����ȴþ����ʱ�����������������Χ�н���__________���������
A��H2 B��O2 C������
�������뺬þ�����йصIJ����У������������IJ�����_____________,ԭ����_____________��
���𰸡���1��NaCl ��2����CaCO3![]() CaO+CO2����Mg2++2OH-=Mg(OH)2��
CaO+CO2����Mg2++2OH-=Mg(OH)2��
������ ��Cl2 �������Ȼ��� ��Լԭ�� A �ܵ�� ���Ĵ�������
��������
�����������1������ͨ����ˮɹ�����NaCl���÷���û�����������ɣ����������仯���������辭����ѧ�仯���ܴӺ�ˮ�л�õ�һ��������NaCl��
��2���ٱ��ǵ���Ҫ�ɷ���CaCO3��̼������ȷֽ����������ƺͶ�����̼������ȼ�ձ���ʱ������Ӧ�Ļ�ѧ����ʽ��CaCO3![]() CaO+CO2������������ˮ��Ӧ����Ca(OH)2�����ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��Mg2++2OH-=Mg(OH)2����
CaO+CO2������������ˮ��Ӧ����Ca(OH)2�����ڳ��������ɵ�Mg(OH)2�����ӷ���ʽ��Mg2++2OH-=Mg(OH)2����
���ɼ������οɼ����ᣬ���˺���Mg(OH)2�м�������ɵõ�MgCl2��Һ������һϵ�в����õ�MgCl2��
�۵������MgCl2�õ�þ������������Cl2����������������Ӧ������HCl��HCl����ˮ�������ᣬ�����������������������е������Ȼ������裬�������ĺô�����Լԭ��,þ������ȴ��Ϊ����þ��þ���ʻ��ã����Ժ������������еĵ�����������CO2��Ӧ������ȴþ����ʱ����������Χ�н�������ѡA��
������������������Ĺ������̣����������뺬þ�����йصIJ����У������������IJ�������⣬ԭ�������Ĵ������ܡ�


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NH2-������ͬ���������͵�����������( )
A. OH- B. NH4+ C. H3O+ D. CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʵ��������ʵ����ʵ����������ȷ����________(�����)��
A�������ô����������������ƻ�̼����
B��ʹ������ƿ������Һʱ�����ӿ̶��߶��ݺ�������ҺŨ��ƫ��
C����Һ����ʱ�����ڷ�Һ©���¶���մ���²�Һ�壬���ϲ�Һ��Ҫ���Ͽڵ���
D����������ƽ����11.74 g�Ȼ��ƾ���
E���ýᾧ����������غ��Ȼ��ƵĻ����
��2��ʵ������Ҫ0.1 mol��L��1 NaOH��Һ450 mL��0.5 mol��L��1������Һ500 mL��������������Һ����������ش��������⣺
����ͼ��ʾ��������������Һ�϶�����Ҫ����____________(�����)������������Һ�����õ��IJ���������________________(����������)��

�����в����У�����ƿ�����߱��Ĺ�����____________(�����)��
A������һ�����ȷŨ�ȵı���Һ
B��������Һ
C����������ƿ������µ����������Һ��
D��ȷϡ��ijһŨ�ȵ���Һ
E�����������ܽ��������
�����������������ƽ��ȡ����NaOH������Ϊ____________g��ijͬѧ��������ƽ�����ձ�����������ƽƽ����״̬��ͼ����ͼ�п��Կ������ձ���ʵ������Ϊ____________g��

�ܸ��ݼ����֪��������������Ϊ98%���ܶ�Ϊ1.84 g��cm��3��Ũ��������Ϊ________mL(����������һλС��)�����ƹ������������ձ��н�Ũ�������ϡ�ͣ�ϡ��ʱ����������____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ������У�Ϊ�˴ﵽ���õ����Ч�����������˻Ὣ���Һ(��������)��84����Һ���ʹ�ã��Ӷ��ᷢ�������ж����¹ʡ�
��1�������ջ���Ʒ��Ҫ�ɷ��ж�������Ԫ�أ���Ԫ����Ԫ�����ڱ���λ���� ��
��2��84����Һ����Ҫ�ɷ��Ǵ������ƣ�д���������Ƶĵ���ʽ�� ��
��3�������£�0��1mol/L��NaClO��Һ��PH=9��7��ԭ�� ��������HClO�ĵ���ƽ�ⳣ��Ϊ �����Һ��84����Һ��Ϻ�������ж���������д���÷�Ӧ�����ӷ���ʽ ��
��4�����������һ�ָ�Ч���ˮ����������ҵ�ϳ�����NaClO��������������Ӧԭ��Ϊ��
���ڼ��������£�����NaClO�������������Ƶ�Na2FeO4���÷�Ӧ�����ӷ�Ӧ����ʽΪ ��
��Na2FeO4��KOH��Ӧ����K2FeO4��Na2FeO4+2KOH=K2FeO4+2NaOH��K2FeO4��ˮ��Һ����ˮ�⣺4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2�������ᴿ��K2FeO4�в����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ��Һ(�����)
4Fe(OH)3+8OH-+3O2�������ᴿ��K2FeO4�в����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ��Һ(�����)
a��ˮ b��NH4Cl������� c��Fe(NO3)3������� d��CH3COONa�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڹ����ŵ��ж���˵��������ǣ� ��
A�����Ĺ��������ǻ�����OH��
B������Ĺ��������ǻ�����OH��
C���ӵĹ��������ǻ�����OH��
D��ϩ���Ĺ�������̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������ϡ���ᷴӦ��Ҳ����Ũ���ᷴӦ����ͭ��һ��Ũ�����ᷴӦʱ���ɽ�����ʽ��ʾΪ��Cu+HNO3 �� Cu��NO3��2+NO��+NO2��+H2O ������ʽδ��ƽ�������� 2NO2 ![]() N2O4����
N2O4����
��1�������ڸ÷�Ӧ�����ֵ�������_________________ _��
��2������μӷ�Ӧ��Cu��HNO3�����ʵ���֮����3:10��д������ƽ�÷�Ӧ�����ӷ���ʽ
_________ ��
��3��0.004molCu��������ȫ�ܽ��Cuʧȥ�ĵ�������____________������õ���NO��NO2���ʵ�����ͬ����μӷ�Ӧ����������ʵ�����____________���ڱ�״���������ռ�NO��NO2�ļ���ƿ������ˮ�У�ͨ��һ������������ַ�Ӧ����������ʣ�࣬��ͨ��O2�����Ϊ________ mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
������F��һ�ֿ��ļ�ȱѪҩ����м��壬����ͨ�����·����ϳɣ�
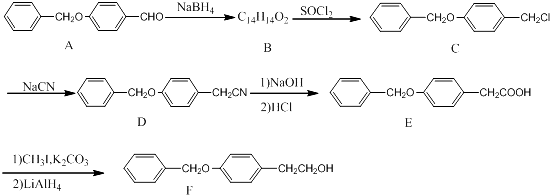
��1��������C�еĹ�����Ϊ ��������ŵ����ƣ���
��2��������B�Ľṹ��ʽΪ �� ��A��B�ķ�Ӧ�����ǣ� ��
��3��ͬʱ��������������A��ͬ���칹���� �֡���д��һ�ַ�����ֻ����6�ֵ�Ч��Ľṹ��ʽ�� ��
�����Ӻ���2��������������������״�ṹ ���ܷ���������Ӧ��ˮ�ⷴӦ
�����ܺ�FeCl3������ɫ��Ӧ����ˮ���������к��м�
��4����֪��RCH2CN![]() RCH2CH2NH2����д����
RCH2CH2NH2����д����![]() Ϊԭ���Ʊ�������X��
Ϊԭ���Ʊ�������X��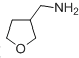 �����ṹ��ʽ��ͼ���ĺϳ�·������ͼ�����Լ�����ѡ���� ��
�����ṹ��ʽ��ͼ���ĺϳ�·������ͼ�����Լ�����ѡ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����з���һ����ѧ��Ӧ����Ӧ�����д���H2O��ClO����CN����HCO3����N2��Cl���������ʣ��ڷ�Ӧ�����в��ClO����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�������й��ж�����ȷ������ ��
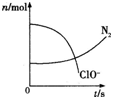
A����ԭ����CN������������ֻ��N2
B����������ClO������ԭ������HCO3��
C����ƽ���������뻹ԭ���ļ���ϵ��֮��Ϊ5��2
D����״����������2.24LN2����ת�Ƶ���0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ��һ�ֳ����㾫����ṹ��ʽΪ
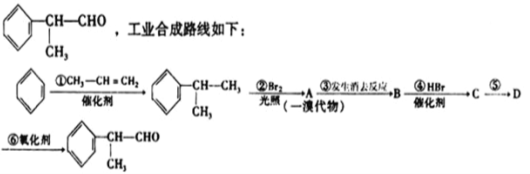
��֪������ͬϵ����±�ص��ʷ�Ӧʱ�����ڹ��������£����������ϵ���ԭ�ӱ�±��ԭ��ȡ�������ڴ��������£�����ijЩλ���ϵ���ԭ�ӱ�±��ԭ��ȡ����
���������·�ߣ��ش���������:
��1��A�Ľṹ��ʽ����Ϊ____________________����Ӧ���ķ�Ӧ����Ϊ
��2���л�������D���ܾ��еĻ�ѧ������___________����д��ţ���
a.ˮ�ⷴӦ b.�Ӿ۷�Ӧ c.ȡ����Ӧ d.��ȥ��Ӧ
��3����������ȩ�й����ŵĻ�ѧ��Ӧ����ʽΪ��_______________________��
��4������ȩ�ж���ͬ���칹�壬��д��һ�ַ�������������ͬ���칹��Ľṹ��ʽ ___________��
����ˮ��Һ��FeCl3��Һ����ɫ���������ϵ�һ����������֣���������û�м���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com