
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化.下列叙述正确的是( ) 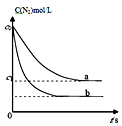
A.若曲线b对应的条件改变是温度,可判断该反应的△H<0
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.温度T下,该反应的平衡常数K= ![]()
【答案】D
【解析】解:A、由图可知,b曲线化学反应速率快(变化幅度大),氮气的平衡浓度减小,升高温度平衡正向移动,则正反应为吸热反应,即△H>0,故A错误; B、反应物和生成物均是气体,故气体的质量m不变,容器为恒容容器,故V不变,那么密度ρ= ![]() 不变,故B错误;
不变,故B错误;
C、由图可知,b曲线氮气的平衡浓度减小,故应是平衡发生移动,催化剂只能改变速率,不能改变平衡,故b曲线不可能是由于催化剂影响的,故C错误;
D、
N2(g)+ | O2(g) | 2NO(g) | |
起(mol/L) | c0 | c0 | 0 |
转(mol/L) | c0 ﹣c1 | c0 ﹣c1 | 2(c0 ﹣c1 ) |
平(mol/L) | c1 | c1 | 2(c0 ﹣c1 ) |
故K= ![]() ,故D正确;
,故D正确;
故选D.
A、由图可知,b曲线化学反应速率快,若是升高温度,氮气的平衡浓度减小,则正反应为吸热反应;
B、此容器为恒容密闭容器,ρ= ![]() ,据此判断即可;
,据此判断即可;
C、催化剂只能改变化学反应速率,不能改变物质的转化率;
D、依据氮气的浓度变化,找出三段式,计算平衡常数即可.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】相等物质的量的KClO3分别发生下述反应:
①有MnO2催化剂存在时,受热完全分解得到氧气;
②若不使用催化剂,加热至470℃左右充分反应,得到KClO4 (高氯酸钾)和KCl。
下列关于①和②的说法不正确的是
A. 都属于氧化还原反应
B. 发生还原反应的元素相同
C. 发生氧化反应的元素不同
D. 生成KCl的质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向100mL H2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示.下列分析中正确的是( ) 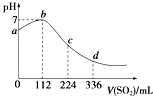
A.b点对应的溶液导电性最强
B.亚硫酸是比氢硫酸更弱的酸
C.ab段反应是SO2+2H2S═3S↓+2H2O
D.原H2S溶液的物质的量浓度为0.05molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点由高到低排列的是( ) ①CH3(CH2)2CH3
②CH3(CH2)3CH3
③(CH3)3CH
④(CH3)2CHCH2CH3 .
A.②④①③
B.④②③①
C.④②①③
D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
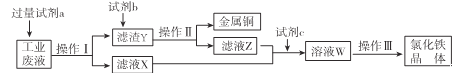
已知:FeCl3在加热情况下与水反应生成Fe(OH)3。
回答下列问题:
(1)试剂a是 ____________,过量的原因______________________。
(2)操作Ⅱ是___________,用到的玻璃仪器___________________________。
(3)若试剂C是Cl2,则反应的离子方程式: __________________________。
(4)滤液X、Z中都有同一种溶质,请设计实验验证该溶质的离子:___________。
(5)操作Ⅲ应该是(______)
A 蒸发 B蒸馏 C 分液 D 结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ba(AlO2)2可溶于水。下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。下列有关叙述正确的是

A. a-b时沉淀的物质的量:Al(OH)3比BaSO4多
B. d-e时溶液中离子的物质的量:Ba2+可能等于OH-
C. a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3
D. c-d时溶液中离子的物质的量:AlO2-比Ba2+少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)室温下,0.1 mol/L NaClO溶液的pH0.1 mol/L Na2SO3溶液的pH. (选填“大于”、“小于”或“等于”).浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32﹣、CO32﹣、HSO3﹣、HCO3﹣ 浓度从大到小的顺序为 .
已知:H2SO3 K1=1.54×10﹣2 K2=1.02×10﹣7 HClO K1=2.95×10﹣8
H2CO3 K1=4.3×10﹣7 K2=5.6×10﹣11
(2)用标准碘溶液滴定容有SO2的水溶液,以测定水中SO2的含量,应选用作指示剂,达到滴定终点的现象是 .
(3)常温下,将amol/lCH3COONa溶于水配成溶液,向其中滴加等体积bmolL﹣1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离平衡常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com