
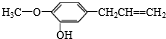
 下列有关佳味备醇的说法中不正确的是( )
下列有关佳味备醇的说法中不正确的是( )| A. | 佳味备醇含有一个苯环,它是一种芳香族化合物 | |
| B. | 佳味备醇可以与溴水发生加成和取代反应,还能与氯化铁溶液发生显色反应 | |
| C. | 佳味备醇分子中至少有十二个原子在同一平面上 | |
| D. | 1mol佳味备醇分别与氢气、溴水反应时,最多消耗4molH2,4molBr2 |
分析 由结构可知,分子中含酚-OH、碳碳双键、苯环、醚键,结合醇、烯烃的性质来解答.
解答 解:A.含苯环,为是一种芳香族化合物,故A正确;
B.含双键与溴水发生加成反应,含酚-OH,其邻位、对位可与溴水发生取代反应,含酚-OH,能与氯化铁溶液发生显色反应,故B正确;
C.苯环、双键为平面结构,与苯环、双键直接相连的原子一定共面,则苯环中6个C、3个H及直接相连的2个O、1个C一定共面,即至少有十二个原子在同一平面上,故C正确;
D.酚-OH,其邻位、对位可与溴水发生取代反应,双键与溴水发生加成反应,则1mol佳味备醇与溴水反应时,最多消耗3molBr2,而1mol佳味备醇与氢气反应时,最多消耗4molH2,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,选项C为解答的难点,侧重酚、烯烃性质的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
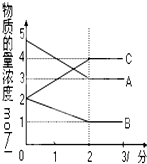 在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题:
在恒容密闭容器中,某反应在不同反应时间各物质的量浓度的变化情况如图所示(各物质均为气体).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
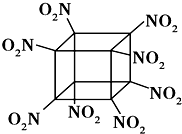 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的物质,下列说法正确的是( )| A. | 分子中不含有非极性键 | B. | 1mol该分子中含8mol二氧化氮 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、C02、H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氢气做还原剂,铝做氧化剂 | |
| B. | 在空气中Al2O3比 B2H6更稳定 | |
| C. | B2H6中存在极性键、非极性键、离子键 | |
| D. | 每生成1mol B2H6要消耗2molAlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com