
| A. | 甲烷和乙烯:分别通入酸性KMnO4溶液 | |
| B. | 苯和四氯化碳:分别与水混合、振荡、静置 | |
| C. | 乙醇和乙酸:分别滴加NaOH溶液 | |
| D. | 棉花织品和羊毛织品:分别燃烧闻气味 |
分析 A.乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应;
B.苯和四氯化碳的密度不同;
C.乙醇与氢氧化钠不反应,乙酸与氢氧化钠反应没有明显现象;
D.羊毛的主要成分为蛋白质.
解答 解:A.乙烯含有碳碳双键,可与酸性高锰酸钾发生氧化还原反应,而甲烷不反应,可鉴别,故A正确;
B.苯不溶于水,密度比水小,四氯化碳不溶于水,但密度比水大,可鉴别,故B正确;
C.乙醇与氢氧化钠不反应,乙酸与氢氧化钠发生中和反应,但反应没有明显现象,不能鉴别,可用石蕊鉴别,故C错误;
D.羊毛的主要成分为蛋白质,灼烧时有烧焦的羽毛气味,可鉴别,故D正确.
故选C.
点评 本题考查有机物的鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握有机物性质的异同,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
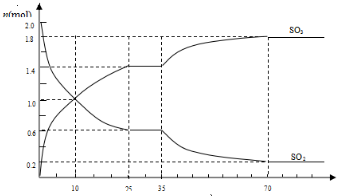
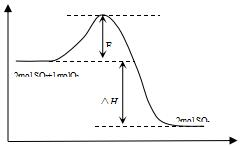 2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.
2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.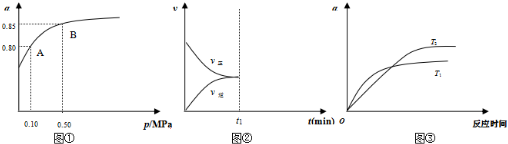
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质可能是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 不能确定该物质中是否含有钾元素 | D. | 该物质一定是金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 酯化反应 | D. | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOOH+CN-═HCOO-+HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入氢气的电极为原电池的正极 | |
| B. | 两极材料都用石墨,用稀盐酸做电解质溶液 | |
| C. | 电解质溶液中的阳离子向通氯气的电极移动 | |
| D. | 通氯气的电极反应式为Cl2+2e-═2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com