
| A. | 最易失去的电子能量最高 | |
| B. | L层电子比K层电子能量高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
分析 A.根据原子核外电子能量与距核远近的关系判断;
B.根据构造原理判断;
C.没有指明p轨道电子和s轨道电子是否处于同一电子层;
D.根据原子核外电子能量与距核远近的关系判断.
解答 解:A.能量越高的电子在离核越远的区域内运动,也就越容易失去,故A正确;
B.电子层能量由低到高依次为(K、L、M、N…)层,L层电子比K层电子能量高,故B正确;
C.同一层即同一能级中的p轨道电子的能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故C错误;
D.能量越低的电子在离核越近的区域内运动,故D正确.
故选C.
点评 本题主要考查多电子原子中核外电子的运动,明确电子的能量不同、电子在核外分层运动是解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 5.6g | C. | 2.8g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C、D能形成5种以上单质 | |
| B. | D能分别与A、B、C反应越来越难 | |
| C. | X、Y、Z的稳定性逐渐增强 | |
| D. | B的气态氢化物能与其最高价含氧酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数=原子核内质子数 | |
| B. | 元素的种数=原子种数 | |
| C. | 元素周期表中主族序数=原子的最外层电子数 | |
| D. | 元素周期表中周期数=原子的电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱可做食品干燥剂 | B. | 经常接触铅笔芯易造成铅中毒 | ||
| C. | 盐类都可以用作调味品 | D. | 蚕丝的主要成分是蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
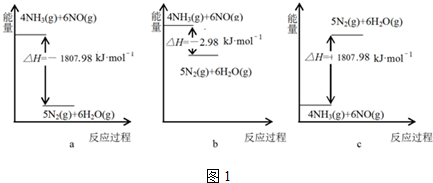
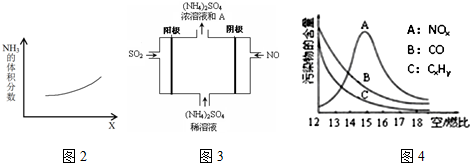
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | OH-+2CO32-+3H+→2HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+3H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com