
分析 (1)原电池能加快金属腐蚀速率;
(2)在原电池中,作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答 解:(1)纯锌和稀硫酸发生化学腐蚀,粗锌中含有锌和其它杂质,锌、杂质和稀硫酸构成原电池,作负极的锌加速被腐蚀,所以粗锌与稀硫酸反应速率快,
故答案为:粗锌和稀硫酸构成原电池而加速粗锌被腐蚀;
(2)在原电池中,作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,马口铁中Fe、Sn和电解质溶液构成原电池时,Fe作负极加速被腐蚀,所以马口铁易生锈;
镀锌铁中,Fe、Zn和电解质溶液构成原电池,Fe作正极而被保护,所以镀锌铁不易生锈,
故答案为:马口铁在形成原电池时Fe作负极而加速被腐蚀;镀锌铁在形成原电池时Fe作正极而被保护.
点评 本题考查金属的腐蚀与防护,为高频考点,明确原电池原理及正负极发生反应类型是解本题关键,会根据原电池原理保护金属防止被腐蚀,会根据化学知识解释生产生活现象,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:实验题
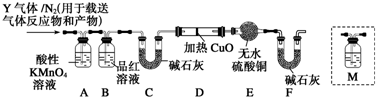
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能显碱性 | B. | 不可能显中性 | ||
| C. | 不可能显酸性 | D. | 可能中性、碱性、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000a%}{98x}$g/ml | B. | $\frac{x}{98a%}$g/mol | C. | $\frac{98x}{a%}$g/ml | D. | $\frac{98x}{10a}$g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 | |
| B. | 麦芽糖和蔗糖互为同分异构体 | |
| C. | 淀粉遇碘化钾溶液变蓝 | |
| D. | 糖类不一定都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
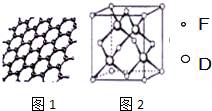 原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.
原子序数依次增大的六种元素A、B、C、D、E、F位于周期表的前四周期.A原子的最外层电子数是其内层电子数的2倍;C有2个电子层且基态原子的s轨道和p轨道的电子总数相等,C与D同主族相邻;E的最外层只有1个电子,但次外层有18个电子;F位于周期表的ds区,最外层有2个电子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com