

 (1分) (2)< (1分) < (1分)
(1分) (2)< (1分) < (1分) 3SO2↑+2H2O (2分)
3SO2↑+2H2O (2分) 3SO2↑+2H2O(S与浓H2SO4发生了氧化还原反应,故应利用化合价升降相等配平方程式)
3SO2↑+2H2O(S与浓H2SO4发生了氧化还原反应,故应利用化合价升降相等配平方程式)

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
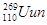 。该原子的原子核内中子数为( )
。该原子的原子核内中子数为( )| A.110 | B.159 | C.161 | D.269 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 电离能 | 锂 | X | Y |
| I2 | 519 | 502 | 580 |
| I2 | 7 296 | 4 570 | 1 820 |
| I3 | 11 799 | 6 920 | 2 750 |
| I4 | | 9 550 | 11 600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c | B.b>a>c | C.c>b>a | D.a>c>b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第七周期有50种元素 | B.该原子的质量数为184 |
| C.该元素的相对原子质量为298 | D.该原子核外有114个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com