
| A. |  | B. | 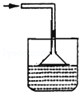 | C. |  | D. |  |
分析 氨气极易溶于水,吸收氨气时不能直接将导管插入水中,必须使用防止倒吸的装置;常用的方法为:使用倒置的漏斗、使用球形漏斗、使用四氯化碳和水的混合液,据此进行判断.
解答 解:A.氨气不溶于四氯化碳,该装置可以防止倒吸,可用于吸收氨气,故A错误;
B.使用倒置的漏斗,可以防止倒吸,可用于吸收氨气尾气,故B错误;
C.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故C错误;
D.氨气极易溶于水,不能直接将导管插入水中,否则容易发生倒吸,故D正确;
故选:D.
点评 本题考查了常见气体的尾气吸收,题目难度不大,注意明确常见的极易溶于水的气体在尾气吸收时,必须使用防止倒吸的装置,要求学生能够正确判断装置是否具有防止倒吸的作用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是无机物,故有机物在水中的溶解度都很小 | |
| B. | 氢键对物质的溶解性没有影响 | |
| C. | 溶质能与水发生化学反应将增大其在水中的溶解度 | |
| D. | CO与水都是极性分子,故CO易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | 仅有一句 | B. | 两句 | C. | 三句 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X属于共价化合物.
,X属于共价化合物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量的SO2:SO2+20H-═SO32-+H20 | |
| B. | Na2O2和H2O反应:Na2O2+H2O═2Na++20H-+02↑ | |
| C. | Cl2和H2O反应:Cl2+H20═2H++Cl-+Cl0- | |
| D. | SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com