
【题目】据报道,我国科学家研制出以石墨烯为载体的催化剂,在25℃下用H2O2直接将CH4转化为含氧有机物,其主要原理如图所示:

下列说法不正确的是( )
A.图中![]() 代表H2O2
代表H2O2
B.步骤i、ii的总反应方程式是![]()
C.由上图可知,步骤iv生成的H2O,其中的H原子全部来自H2O2
D.根据以上原理,推测步骤vi生成HCOOH和H2O
科目:高中化学 来源: 题型:
【题目】如图是硫酸试剂瓶标签上的内容:

![]() 该硫酸的物质的量浓度为______
该硫酸的物质的量浓度为______![]() 。
。
![]() 某化学小组进行硫酸酸性实验探究时,需要配制
某化学小组进行硫酸酸性实验探究时,需要配制![]() 的稀硫酸,则需要取上述的浓硫酸______mL。
的稀硫酸,则需要取上述的浓硫酸______mL。
(3)下列情况使所配制硫酸溶液物质的量浓度偏高的是________,
A.未经冷却趁热将溶液注入容量瓶中
B.定容时仰视读数
C.移液时不慎将少量溶液滴在容量瓶外面
D.用量筒量取浓硫酸时仰视读数
E.加蒸馏水时不慎超过了刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出化学方程式:
(1)丙烯和氯气的取代反应:________。
(2)由苯酚和甲醛合成酚醛树脂:________。
(3)苯酚和浓溴水反应:_________。
(4)烷烃的燃烧通式:_____。
(5)实验室制备乙烯的反应原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨碱法(索氏)和联合制碱法(侯氏)对比分析,错误的是
A.产品完全相同B.生产NaHCO3的反应原理相同
C.食盐利用率不同D.都循环利用了CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化镁(MgO2)不溶于水,与酸反应生成H2O2,在医学上可作解酸剂。常温下MgO2较稳定,加热时会分解生成O2和MgO。MgO与H2O2反应可制得MgO2,同时放出大量热。一种制备MgO2的流程如图所示:
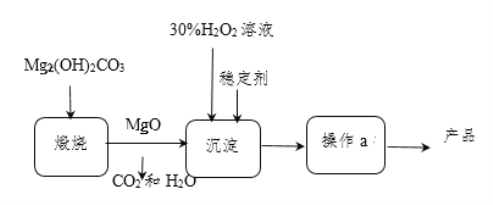
请回答下列问题:
(1)煅烧Mg2(OH)2CO3的化学反应方程式为_______________________;检验Mg2(OH)2CO3已分解完全的方法是______________________________。(写出实验操作和现象)
(2)上述制备过程中加入稳定剂的作用是___________;操作a为_____________。
MgO2产品中常会混有少量MgO,实验室可通过多种方案测定样品中MgO2的含量。某研究小组拟用下图装置测定样品(含MgO杂质)中MgO2的含量。
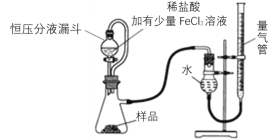
(3)研究小组的实验原理是(用化学方程式表示)①___________________________;
②2H2O2 → 2H2O +O2↑,稀盐酸中加入少量FeCl3溶液的作用是_______________。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、___________。
(5)反应结束后,先_________________,然后__________________,最后平视刻度线读数并记录。
(6)该小组记录的实验数据如下,样品的质量为m g;反应开始前量气管的读数为a mL;反应结束后量气管的读数为b mL,则样品中过氧化镁的质量分数为______(该实验条件下O2密度为ρ gL-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入_____(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__,是否符合排放标准__(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×1017 ,Ksp(AgSCN,白色)= 1.0×1012 。
回答下列问题:
(4)步骤3中现象a是_______。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种高效的杀菌消毒剂,也常用来漂白织物等。用下列装置探究NaClO2的制备。
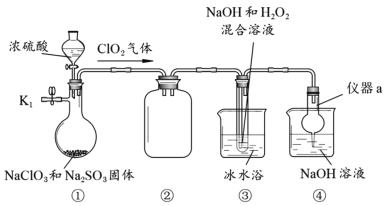
完成下列填空:
(1)仪器a的名称为__________,装置②的作用是________________。
(2)检查装置气密性的方法是________________________________________________。
(3)关闭K1,从分液漏斗中加入一定量浓硫酸,装置③中生成NaClO2的化学方程式为2ClO2+2NaOH+H2O2→2NaClO2+2H2O+O2↑,该反应的氧化产物是_____________。
(4)实验完成后,为防止装置中残留的有毒气体污染空气,可以进行的操作是:打开止水夹K1,____________________________________________。
(5)从装置③的溶液中获得NaClO2晶体的主要操作有减压蒸发浓缩、________________、过滤洗涤、干燥等。
(6)晶体以NaClO2·3H2O的形式存在,已知:NaClO2·3H2O![]() NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
NaCl+O2↑+3H2O↑。为测定所得固体中NaClO2·3H2O的质量分数,在收集到足量的晶体后,进行如下实验:取样品质量为a g,灼烧恒重后,得到固体b g。则晶体中NaClO2·3H2O的质量分数是__________。
若发生副反应4[NaClO2·3H2O]![]() 2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
2NaCl+2NaClO3+O2↑+12H2O↑,则实验测得的值会__________。(选填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个热化学方程式:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(l) ΔH=-2220.0 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
则0.5 mol丙烷燃烧生成CO2和气态水时释放的热量为 。
(2)已知:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN![]() N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
(4)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:
2H2+O2 2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将___________能转化为__________能。其电极反应式分别为:负极_________________,正极____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com