
����Ŀ������50mL0.50mol/L������50mLһ��Ũ�ȵ�NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ�� 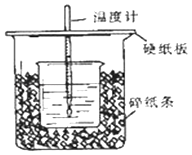
ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ���װ�����������ԵĴ�������һ����ȱ��һ�ֲ��������������������� �� ��һ�������� ��
��ʵ�����ṩ��0.50mol/L��0.55mol/L����Ũ�ȵ�NaOH��Һ��Ӧ��ѡ��molL��1����Һ����ʵ�飮���ձ����粻��Ӳֽ�壬��õ��к�����ֵ���ƫ��ƫС����Ӱ�족����
���������ͬŨ�Ⱥ�����Ĵ��ᣨCH3COOH������HCl��Һ��������ʵ�飬��õ��к��ȵ���ֵ�������ƫ��ƫС����Ӱ�족�� �����60mL0.50mol/L������50mL0.55mol/L��NaOH��Һ�����к��������ȡ�����ȡ�����
���𰸡����β����������С�ձ��ںʹ��ձ���û��ƽ�룻0.55��ƫС��ƫС�����
���������⣺�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�����������к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹����������ձ�Ϊһ���ߣ���������ɢʧ�����Դ��ǣ����β����������С�ձ��ںʹ��ձ���û��ƽ�룻��ʵ�����ṩ��0.50molL��1��0.55molL��1����Ũ�ȵ�NaOH��Һ��Ϊ��ʹ��Ӧ��֣�NaOHӦ����������ѡ��0.55molL��1����Һ����ʵ�飻���ձ����粻��Ӳֽ�壬����һ��������ɢʧ����õ��к�����ֵ�����С�����Դ��ǣ�0.55��ƫС���۴���Ϊ���ᣬ�������Ϊ���ȹ��̣����Դ��ᣨCH3COOH������HCl��Һ��Ӧ����Ӧ�ų�������ƫС���к��ȵ���ֵ��ƫС����Ӧ�ų����������������Լ�������Ķ����йأ������60mL0.50mol/L������50mL0.55mol/L��NaOH��Һ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ��к�����ֵ��ȣ����Դ��ǣ�ƫС����ȣ�


 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
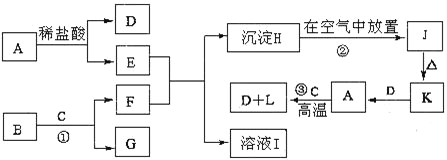
����Ŀ������ΪһЩ�������ʵ��ת����ϵͼ����֪��A�ǽ������ʣ�BΪ����ɫ��ĩ��C�ڳ�����Ϊ��ɫҺ�壬JΪ���ɫ���塣
�����
��1��A�Ļ�ѧʽ��A______________
��2��������ҺE�Ƿ���ʵķ���_________________________________________________��
��3������K��һ����; __________________________________��
��4����Ӧ�������ӷ���ʽ___________________________________________��
��5������Hת��Ϊ����J������Ϊ ________________________________________________________����Ӧ�ڵĻ�ѧ����ʽΪ ____________________________________________________________��
��6����Ӧ���Ļ�ѧ����ʽ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����ܹ��ɹ��Ʊ�Fe(OH)3��������� ��
A. ��1 mL����FeCl3��Һ���뵽20 mL NaOH��Һ
B. ��1 mL����FeCl3��Һ��μ��뵽20 mL��ˮ�У��ӱ��������ȵ�����
C. ��1 mL����FeCl3��Һһ���Լ��뵽20 mL��ˮ�У������Խ���
D. ��5-6�α���FeCl3��Һ��μ��뵽20 mL��ˮ�У�����������ʺ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʯ�ͼ۸�Ӱ����С���ǣ� ��
A.����ϩ
B.�ϳ�ϴ�Ӽ�
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ҿ�����KMnO4�����Ũ���ᷴӦ��ȡ����Cl2����Ӧ�Ļ�ѧ����ʽΪ��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O�ش��������⣺
��1���÷�Ӧ�б�������Ԫ����__________��
��2�������ԣ�KMnO4__________Cl2����������������������=����
��3���÷�Ӧ����������������������ʵ���֮��Ϊ__________��
��4����˫���ŷ���ʾ�÷�Ӧ�е���ת�Ƶķ������Ŀ��_________
2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O
��5��ÿ���ɱ�״����2.24L Cl2����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__________��
����ʵ���ҳ������·�����ȡ������MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O���������ѧ֪ʶ�ش��������⣺
MnCl2��Cl2����2H2O���������ѧ֪ʶ�ش��������⣺
��1��������ͨ����ɫʯ����Һ�У����Թ۲쵽�������ǣ�________________������������е�ԭ�� __________________________________________________
��2��Ϊ��֤ʵ�鰲ȫ������NaOH��Һ���ն����������д����Ӧ�Ļ�ѧ����ʽ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
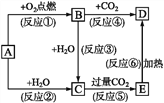
����Ŀ������ͼʾ�У�A��һ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ�Ļ�����ʻ�ɫ��
��д���пհ�:
(1)д����ѧʽ:A_____��B_____��D______________��
(2)���Ϸ�Ӧ������������ԭ��Ӧ����_____(�����)��
(3)д����Ӧ�ݵ����ӷ���ʽ:___��д����Ӧ�Ļ�ѧ����ʽ:___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH4Al��SO4��2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ������ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
��1����ͬ�����£�pH��ͬ��NH4Al��SO4��2��c��NH4+�����=����������������NH4HSO4��c��NH4+����
��2����ͼ1��0.1molL��1�������Һ��pH���¶ȱ仯��ͼ�� 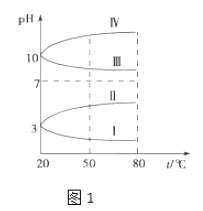
�����з���0.1molL��1NH4Al��SO4��2��pH���¶ȱ仯������������д��ĸ����
������ʱ��0.1molL��1NH4Al��SO4��2��2c��SO42������c��NH4+����3c��Al3+��=molL��1������ֵ��
��3������ʱ����100mL 0.1molL��1NH4HSO4��Һ�еμ�0.1molL��1NaOH��Һ���õ�����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ�� 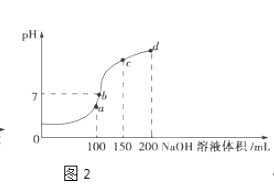
�Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�����������c�㣬��Һ�и�����Ũ���ɴ�С������˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ�ҵ������Ӧ�ù㷺��ij���н����٣�W����WO2��WO3��W2O5�Ļ������Ӹû�����з����WO3��W2O5����ұ�������٣���������ͼ��ʾ��
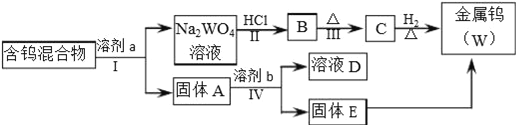
���Ķ����Ͽ�Ƭ���ش��������⣮
�����Ͽ�Ƭ��
i��WO3������NaOH��Na2CO3��Na2C2O4�������ƣ���Һ���γ������Σ�Na2WO4����W2O5�ױ�������Ҳ���ܽ���������Һ�У������ٺ�WO2������������Һ��
ii��WO3�����������ᷴӦ��
iii���ٻ������ڲ�ͬ�ܼ��еĽ�ȡ�ʼ��±�����ȡ�����ܼ��ܽ��������Է����������ּ������Ĺ��̣�����ȡ��Ϊ100%��������еĿ������ȫ���ܽ����ܼ��У���
�ܼ� | ���ʱ�䣨min�� | W2O5��%�� | WO3��%�� | WO2 | ������ |
��100g/L NaOH ��300g/LNa2CO3 ��50g/L Na2CO3 �ܱ���Na2C2O4 �ݱ���Na2C2O4����CO2�����½�ȡ�� | 25 7 30 60 120 | 72.3 76.4 100 4.2 ��0.5 | 100 100 100 100 100 | δ��� | δ��� |
��1�������͢���Ҫ���еIJ�����_______________________________________��
��2�������Ӧ�Ļ�ѧ����ʽ�ֱ���_____________��_____________��
��3��WO3�����ڽ��������Ҳ����____������ԡ��������ԡ����������NaOH��Һ��Ӧ�����ӷ���ʽ��___________________________��
��4��������ǽ�WO3���������ѡ�õ��Լ�a�Ǣݣ�������______��
��5��������ɽ�W2O5���������ѡ�õ��Լ�b��____������E�к��е�������___��D�е�������____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com