
(1)A、B、C、G为四种单质,常温下A、B、G是气体,C为固体;
(2)C、H、I、M含有同一种元素;
(3)D、K、L是气态化合物,其中D极易溶于水,L能溶于水,而K难溶于水;
(4)F是一种五色液体;
(5)M的焰色反应呈黄色。
这几种物质问的转化关系如下图所示:
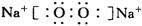
请填写以下空白:
(1)写出化合物D、J的化学式:D_________,J_________。
(2)化合物I的电子式:_________,L分子的空间构型:_________。
(3)写出反应①的化学方程式:_______________________________;
写出反应②的离子方程式:_________________________________。
(4)反应②用于工业生产时,目前采用的比较先进的技术是_________,从安全方面考虑它可防止_____________________________________________________________________。
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:扬州市2006~2007学年度第二学期期末调研测试试题、高二化学 题型:022
下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件已略去),已知:
(1)A、B、C、D是常见的非金属单质,常温常压下,A、B、C是气体.(2)反应①是化工生产中的重要反应.(3)G是一种常见的溶剂,化合物H是我国形成酸雨的主要污染物之一,L是常见的氮肥,I是胃酸的主要成分.(4)化合物F由两种元素组成,其相对分子质量为135.

请按要求填空:
(1)E的电子式________,F的分子式________.
(2)反应③的离子方程式________.
(3)反应②的化学方程式________.
查看答案和解析>>
科目:高中化学 来源:辽宁省期末题 题型:推断题
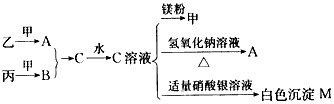
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com