
【题目】如图电化学原理可用于治理水中硝酸盐的污染,下列说法不正确的是
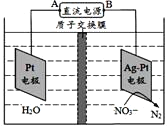
A. A为电源正极
B. 在Pt电极上发生氧化反应
C. 阴极电极反应式为2NO3-+6H2O+10e-=N2+12OH
D. 质子从Pt电极移向Ag-Pt电极
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】(一)常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。
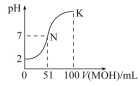
(1)由图中信息可知HA为____________酸(填“强”或“弱”)。
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7,用离子方程式表示其原因_________________,此时,溶液中水电离出的c(OH-)=__________mol·L-1。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_____________________
(4)K点所对应的溶液中,c(M+)+c(MOH)__________2c(A-)
(二)Ⅰ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001 moL·L-1酸性KMnO4溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO4-+5HS03-+H+= 2Mn2++5SO42-+3H2O。
请完成下列问题:
(1)该滴定实验所需仪器有下列中的________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL) C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹 G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)本实验________(填“需要”或“不需要”)使用指示剂,理由是___________________
Ⅱ.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制1 mol·L-1稀硫酸标准溶液。然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是________(填序号)。
A.实验中所用到的滴定管、容量瓶在使用前均需要查漏
B.若选用100 mL容量瓶配制标准酸溶液,需用密度为1.84 g·mL-1、98%的浓硫酸5.43 mL
C.容量瓶中有少量的蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大
E.若配制标准酸溶液在定容时俯视读数,则导致所测的NaOH溶液浓度偏大
F.中和滴定实验,若滴定前平视读数、滴定结束俯视读数,则导致实验结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
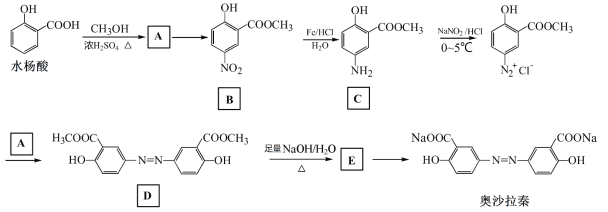
回答下列问题:
(1) A的结构简式为______;由A制备B的反应试剂和条件为______。
(2) 由B制备C的反应类型为______。
(3)由D生成E的反应方程式为______。
(4) 工业上常采用廉价的CO2与E反应制备奥沙拉秦,通入的CO2与E的物质的量之比至少应为______。
(5) 奥沙拉秦的化学式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(6) F是水杨酸的同分异构体,可以发生银镜反应;F经碱催化水解后再酸化可以得到对苯二酚。F的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.反应C(s)+H2O(g)![]() CO(g)+H2(g)达平衡后,加入单质碳平衡必定向正反应方向移动
CO(g)+H2(g)达平衡后,加入单质碳平衡必定向正反应方向移动
B.A2(g)+3B2(g)![]() 2AB3(g)达平衡后,若保待容器压强不变,继续通入0.2mol A2和0.6mol B2,平衡向正反应方向移动,则A2的转化率一定变大
2AB3(g)达平衡后,若保待容器压强不变,继续通入0.2mol A2和0.6mol B2,平衡向正反应方向移动,则A2的转化率一定变大
C.2RO2(g)+O2(g)![]() 2RO3(g) △H=-197kJ·mol-1,升高温度,正反应速率减小
2RO3(g) △H=-197kJ·mol-1,升高温度,正反应速率减小
D.在一定温度下,一定容积的密闭容器中发生反应:C(s)+H2O(g)![]() H2(g)+CO(g),当混合气体的相对平均分子质量不再发生变化时,反应达到平衡
H2(g)+CO(g),当混合气体的相对平均分子质量不再发生变化时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,密闭容器中进行反应:X(g)+4Y(g)![]() 2Z(g)+3R(g),其中X、Y、Z、R的起始浓度依次为0.1、0.4、0.2、0.3(单位均为mol·L-1,下同),则达平衡时,各物质的浓度不可能的是
2Z(g)+3R(g),其中X、Y、Z、R的起始浓度依次为0.1、0.4、0.2、0.3(单位均为mol·L-1,下同),则达平衡时,各物质的浓度不可能的是
A.c(X)=0.15B.c(Z)=0.3C.c(Y)=0.9D.c(R)=0.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
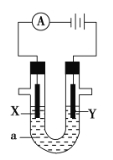
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中Y电极上的电极反应式为 。在Y电极附近观察到的实验现象是 ;检验该电极反应产物的方法是 。
②X电极上的电极反应式为 。
(2)如要用电解方法精炼粗镍,电解液a选用Ni(NO3)2溶液,则:
①X电极的材料是 ,电极反应式为 ;
②Y极的材料是 ,电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成一种化合物M具有如下性质下列推断正确的是( )
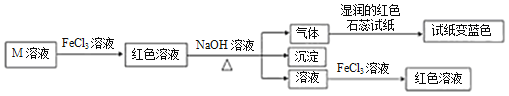
A.原子半径:Z>Y>X>W
B.最高价氧化物对应的水化物酸性:Y>X
C.简单阴离子的还原性: Z>W
D.W、Y、Z组成的化合物只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构如图。有关核黄素的下列说法中,不正确的是( )
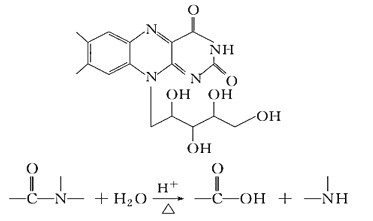
A. 该有机物的分子式为C17H21N4O6
B. 酸性条件下加热水解,有CO2生成
C. 酸性条件下加热水解,所得溶液加碱后有NH3生成
D. 该化合物能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com