
 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.
;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是0.2mol.分析 (1)制备气体的一般顺序为:发生装置,除杂、干燥装置,检验性质,尾气吸收装置;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;反应中锰元素化合价从+4价降为+2价,氯化氢氯元素从-1价升高为氯气中的0价,反应1mol二氧化锰,消耗4mol氯化氢,生成1mol氯气,其中被氧化的氯化氢物质的量为2mol,转移电子2mol;
(3)铜在氯气燃烧生成氯化铜沉淀;脱脂棉的作用是防止CuCl2固体小颗粒被气体鼓入导管中,堵塞导管.
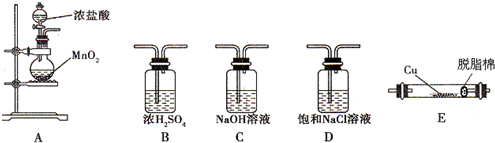
解答 解:(1)实验室用A装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶C和盛有浓硫酸的洗气瓶B,除杂干燥后通入装置E检验氯气和铜的反应,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置C吸收,所以正确的顺序为:ADBEC;
故答案为:ADBEC;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子方程式:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O;反应中锰元素化合价从+4价降为+2价,氯化氢氯元素从-1价升高为氯气中的0价,用双线去桥表示为: ;
;
反应1mol二氧化锰,消耗4mol氯化氢,生成1mol氯气,其中被氧化的氯化氢物质的量为2mol,转移电子2mol,则若在标准状态下收集到2.24L氯气,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,被氧化的HCl的物质的量是0.2mol;
故答案为: ;0.2;
;0.2;
(3)铜在氯气的环境中剧烈燃烧,产生棕黄色的氯化铜颗粒,固体颗粒为烟,脱脂棉的作用是防止固体冲出,阻塞导管,
故答案为:剧烈燃烧,产生棕黄色烟;防止固体冲出,阻塞导管.
点评 本题考查了氯气的实验室制法和氯气的性质,氧化还原反应的规律,明确氯气制备原理的氯气性质是解题关键,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:多选题
 三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )| A. | 三聚氰胺是一种蛋白质 | B. | 三聚氰胺不是高分子化合物 | ||
| C. | 三聚氰胺分子中含有碳碳双键 | D. | 三聚氰胺的分子式为C3H6N6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,反应中镁和铝的关系说法正确的是( )| A. | 镁和铝消耗硫酸的物质的量之比是2:3 | |
| B. | 参加反应的镁、铝的质量之比是8:9 | |
| C. | 反应中消耗的镁、铝的物质的量之比是3:2 | |
| D. | 反应中镁、铝转移电子的物质的量之比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com