
| 实验变量 实验序号 | 银氨溶液量 (ml) | 乙醛的量 (滴) | 水浴温度 (℃) | 反应混合液PH | 出现银镜时间(min) |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
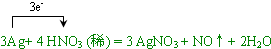 ,
,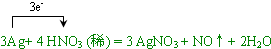 ;
;

科目:高中化学 来源: 题型:
| A、2FeCl3(aq)+2KI(aq)═2FeCl2(aq)+2KCl(aq)+I2(aq)△H<0 |
| B、Ba(OH)2?8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3?H2O(aq)+8H2O(l)△H>0 |
| C、4Al(s)+6H2O(l)+3O2(g)═4Al(OH)3(s)△H<0 |
| D、Zn(s)+2MnO2(s)+2H2O(l)═2MnOOH(s)+Zn(OH)2(s)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
2- 7 |
| 电解 |
| 还原 |
| 沉淀 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下面的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝.A、B、C的物质的量之比为1:1:1.
下面的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝.A、B、C的物质的量之比为1:1:1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| D | E | F |
| A、D的单质是常见的半导体材料 |
| B、B与E形成的化合物不只一种 |
| C、C与F的原子序数之差一定为8 |
| D、C属于卤族元素,对应的单质能与水反应生成两种酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
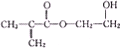 甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )
甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )| A、能发生加成反应 |
| B、能发生取代反应 |
| C、一定条件下,能与乙醇发生酯化反应 |
| D、既能是溴水褪色,又能使酸性高猛酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com