
| 2×9+2-10 |
| 2 |
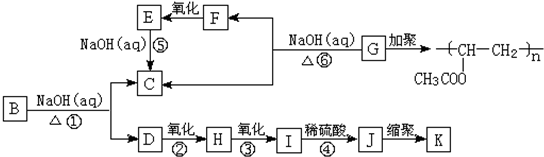
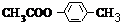 ,B为
,B为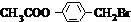 ,D为
,D为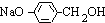 ,H为
,H为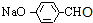 ,I为
,I为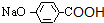 ,J为
,J为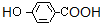 ,K为
,K为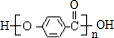 ,据此解答.
,据此解答.| 2×9+2-10 |
| 2 |
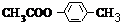 ,B为
,B为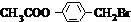 ,D为
,D为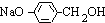 ,H为
,H为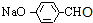 ,I为
,I为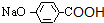 ,J为
,J为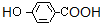 ,K为
,K为 ,
,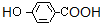 ,J生成K的反应是发生缩聚反应形成酯基,反应的方程式为n
,J生成K的反应是发生缩聚反应形成酯基,反应的方程式为n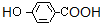
| 浓硫酸 |
| △ |
 +(n-1)H2O,
+(n-1)H2O,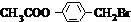 在氢氧化钠水溶液、加热条件下发生水解反应生成CH3COONa与
在氢氧化钠水溶液、加热条件下发生水解反应生成CH3COONa与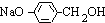 ,反应方程式为:
,反应方程式为: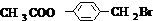 +3NaOH
+3NaOH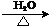 CH3COONa+
CH3COONa+ +NaBr+H2O;
+NaBr+H2O; ,
,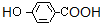
| 浓硫酸 |
| △ |
 +(n-1)H2O;
+(n-1)H2O;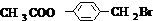 +3NaOH
+3NaOH CH3COONa+
CH3COONa+ +NaBr+H2O;
+NaBr+H2O; ;
;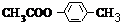 ,同时符合下列要求的A的同分异构体:
,同时符合下列要求的A的同分异构体: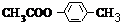 的同分异构体为:
的同分异构体为: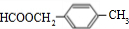 ,
,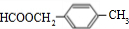 .
.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+=Al(OH)3 | ||||
B、NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH-
| ||||
| C、明矾溶于水产生Al(OH)3 胶体:Al3++3H2O=Al(OH)3↓+3H+ | ||||
| D、FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
 | 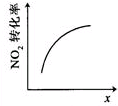 |  | 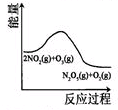 |
| t1时仅加入催化剂,平 衡向正方向移动 | 达平衡时,仅改变x, 则x为c(O2) | 从反应开始达平衡气体浓度变化 | 升高温度,平衡常数 减小 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
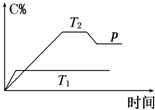 在一定条件下,可逆反应A+B?m C变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?m C变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取无水硫酸铜16 g溶于水配1L溶液 |
| B、取25 g胆矾溶于水配成1L溶液 |
| C、取16 g胆矾溶于1L水中配成 |
| D、取25 g胆矾溶于1L水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com