
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3H2(g)![]() 2NH3(g)
2NH3(g)
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =__________mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),
n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
【答案】(1)16mol;(2)8mol;(3)5:4;(4)2:3 ;(5)1:2 ;(6)3:3:2。
【解析】
试题分析:(1)根据方程式计算:
N2 (g) + 3H2(g) ![]() 2NH3(g),
2NH3(g),
起始(mol):a b 0
转化(mol):3 9 6
t时刻(mol):a-3 b-9 6
所以a-3=13,则a=16,
(2)反应达平衡时,混合气体的物质的量为n(总)=716.8L÷22.4L/mol=32mol,由于其中NH3的含量(体积分数)为25%,则含有NH3的物质的量为32mol×25%=8mol;
(3)利用差量法计算:
N2 (g) + 3H2(g) ![]() 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n
起始 1mol 3mol 2mol 2mol
转化: 4mol 12mol 8mol 8mol
故原混合气体为32mol+8mol=40mol,则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4;(4)有(1)知a=16mol,故原混合气体为32mol+8mol=40mol,则b=40mol-16mol=24mol,所以a:b=16mol:24mol=2:3;(5)达到平衡时,N2和H2的转化率之比α(N2):α(H2)=(4mol÷16mol):(12mol÷24mol)=1:2.(6)平衡混合气的组成为:N2为16mol-4mol=12 mol,NH3为8 mol,H2为32mol-12mol-8mol=12mol,平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】【化学——化学与技术】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
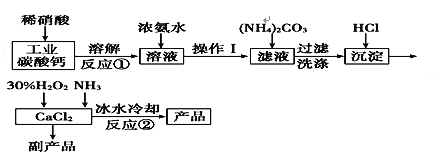
已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①中氧化还原反应的离子方程式:___________________________。
(2)向反应①后的溶液中加浓氨水的目的是:___________,________(用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________________;②__________________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。已知:I2+2S2O===2I-+S4O。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”“偏低”或“偏高”),原因是____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A.Cl-、Br-、CrO42- B.CrO42-、Br、Cl- C.Br-、Cl-、CrO42- D.Br、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,固定体积的密闭容器内,反应2HI(g)![]() H2 (g)+ I2 (g)达到平衡状态的标志是:
H2 (g)+ I2 (g)达到平衡状态的标志是:
①I2的体积分数不再变化;
②生成1 mol H2同时消耗1 molI2;
③容器内压强不再变化;
④生成2 mol HI同时消耗1molH2;
⑤气体的密度不再变化;
⑥混合气体的平均分子质量不再变化
A.①②③④⑤⑥ B.①②③⑤⑥ C.①②⑤⑥ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备AlC13溶液,并用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备新型的超导材料和发光材料七铝十二钙 (12CaO·7Al2O3)。已知A1C13易水解,易升华。
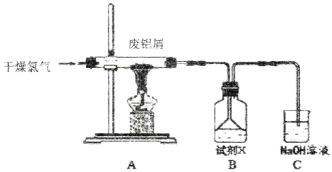
(1)①实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为____________;
②C装置的作用____________;
(2)氯气与废铝屑反应生成的AlC13蒸气溶解在B中,B中盛放的试剂X是____________;为了防止AlC13蒸气凝华堵塞导管,实验中可采取的措施是____________(写出一点)。
(3)B装置中的AlC13溶液溶解CaCO3时,AlC13溶液和碳酸钙粉末的混合方式为____________;
(4)实验要控制碳酸钙和AlC13的量,要求n(CaCO3): n(A1C13)> 12:14,其原因是____________;
(5)以工业碳酸钙(含有少量A12O3、Fe2O3杂质)生产二水合氯化钙(CaC12·2H2O)的方法为:将工业碳酸钙溶于盐酸,____________。
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)

(实验中需用到的试剂和仪器有:盐酸,氢氧化钙,冰水,pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
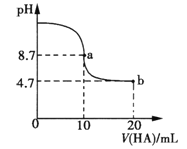
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,甲醚可作燃料电池的燃料。
(1)甲醚(CH3OCH3)与 (填结构简式)互为同分异构体。
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g),反应放热。
CH3OCH3(g)+3H2O(g),反应放热。
I.一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应到达化学平衡状态的是 (选填编号,注意大小写)
a. c(H2)与c(H2O)的比值保持不变
b. 单位时间内有2molH2消耗时有1molH2O生成
c. 容器中气体密度不再改变
d. 容器中气体压强不再改变
II.温度升高,该化学平衡逆向移动后到达新平衡,混合气体的平均相对分子质量将 (填“变大”、“变小”或“不变”)
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该燃料电池的负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
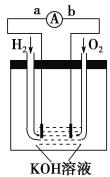
(1)氢氧燃料电池的能量转化的主要形式是由_____________,
在导线中电子流动方向为__________(用a、b表示)。
(2)负极反应式为____________________________。
(3)电极表面镀铂粉的原因是___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断
提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种
重要的储氢材料,吸氢和放氢原理如下:
Ⅰ 2Li+H2![]() 2LiH Ⅱ LiH+H2O===LiOH+H2↑
2LiH Ⅱ LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________,反应Ⅱ中的氧化剂是________。(均填化学式)
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,则被吸收的H2体积与生成的LiH体积比为______________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机反应![]() 制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
制取副产品盐酸的设想己成为现实。请根据所给模拟装置图回答下列问题:
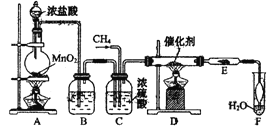
(1)写出实验室制Cl2的离子方程式________________________。
(2)装置B中盛放的溶液是____________;作用是___________________。
(3)装置C有三种功能:①_________;②__________;③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是:_______________。导管末端“肚形”装置的作用是____________________________。
(5)从F中分离出盐酸的最佳方法是____________。该套实验装置还存在的缺陷是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com