
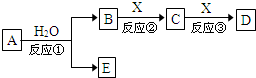
 由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).
由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).分析 (1)若A为氧化物,其焰色反应显黄色,说明含有钠元素,可能为氧化钠或过氧化钠,但与水反应生成两种物质,则A为Na2O2,E为O2,B为NaOH,X为空气成分,B、C、D溶液均显碱性,则X为CO2,C为Na2CO3,D为NaHCO3;
(2)若反应①为通电电解,是重要的工业反应之一,且在水溶液中进行,一般为氯碱工业,A为NaCl,B为有色气体单质,应为Cl2,X是生产生活中使用最广泛的金属,由转化关系可知存在变价,应为Fe,则C为FeCl3,D为FeCl2;
(3)B、E都能使酚酞试液变红,B、E为碱性物质,A由两种元素构成,与水反应生成B和E,B为气体,E为白色沉淀,则A氮化镁,B为氨气,E为氢氧化镁;
(4)75% B的水溶液常用于医疗消毒,则B为乙醇,A分子含有4个碳原子,D、E是同种有机物,则A为乙酸乙酯.
解答 解:(1)若A为氧化物,其焰色反应显黄色,说明含有钠元素,可能为氧化钠或过氧化钠,但与水反应生成两种物质,则A为Na2O2,E为O2,B为NaOH,X为空气成分,B、C、D溶液均显碱性,则X为CO2,C为Na2CO3,D为NaHCO3,NaHCO3常用作为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,
故答案为:发酵粉或治疗胃酸过多等;
(2)若反应①为通电电解,是重要的工业反应之一,且在水溶液中进行,一般为氯碱工业,A为NaCl,B为有色气体单质,应为Cl2,X是生产生活中使用最广泛的金属,由转化关系可知存在变价,应为Fe,则C为FeCl3,D为FeCl2,反应①为电解氯化钠溶液的反应,方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(3)B、E都能使酚酞试液变红,B、E为碱性物质,A由两种元素构成,与水反应生成B和E,B为气体,E为白色沉淀,则A氮化镁,B为氨气,E为氢氧化镁,反应①的化学反应方程式为Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑;
(4)75% B的水溶液常用于医疗消毒,则B为乙醇,A分子含有4个碳原子,D、E是同种有机物,则A为乙酸乙酯,反应②的化学反应方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O.
点评 本题考查无机物的推断,是高考中的常见题型,试题综合性强,难度较大,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、以及灵活运用基础知识解决实际问题的能力.做好本题的关键之处在于把握好常见物质的性质以及有关转化,并能结合题意具体问题、具体分析即可.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
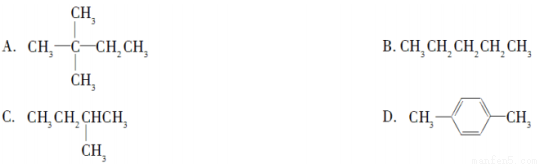
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
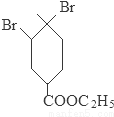 +2NaOH
+2NaOH
 +2NaBr+2H2O;
+2NaBr+2H2O;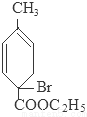 +2H2O
+2H2O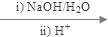
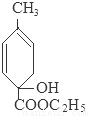 +C2H5OH+HBr:
+C2H5OH+HBr: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液于水时仅破坏了离子键而未破坏共价键 | |
| B. | NH4Cl溶解于水时不仅破坏了离子键还破坏了共价键 | |
| C. | H2SO4溶解于水时,所有的共价键都被破坏 | |
| D. | HCl溶解于水时电离出H+和Cl-,所以共价键变成了离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐.下列判断错误的是( )| A. | 最简单气态氢化物的稳定性:X>Y | |
| B. | 单核阴离子半径:Z>W | |
| C. | 含Z元素的盐溶液可能显酸性、碱性或中性 | |
| D. | W元素的单质具有漂白性,常用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
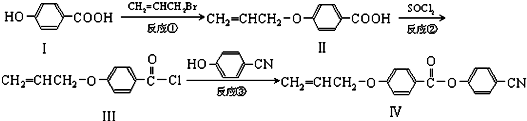
 .
. 也可与III发生类似反应③的反应,生成有机物V,V的结构简式是
也可与III发生类似反应③的反应,生成有机物V,V的结构简式是 .
.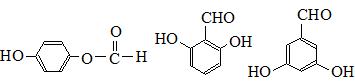 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com