
分析 因黑色生成物(C)与白色生成物(MgO)的物质的量之比为1:4,故氧气过量,通过浓硫酸后的气体为CO2和O2的混合物.设Mg与O2、CO2反应分别生成MgO的物质的量为x、y:
2Mg+O2═2MgO 2Mg+CO2═2MgO+C.
0.5x x y 0.5y
$\left\{\begin{array}{l}40g•mo{l^{-1}}(x+y)+12g•mo{l^{-1}}×0.5y=5.16g\\ x+y=4×0.5y\end{array}\right.$
解得:x=y=0.06mol,过量的n(CO2)=0.03mol,生成的n(CO2)=0.03mol,生成的n(H2O)=$\frac{0.54g}{18g•mo{l}^{-1}}$=0.03mol,0.01molA的质量m(A)=[0.03×44+0.54-($\frac{1.456}{22.4}-0.03$)×32]g=0.74g,M(A)=$\frac{0.74g}{0.01mol}$=74g•mol-1
设A的分子式为C3H6Oz,从而确定z的值,求出分子式.
解答 解:因黑色生成物(C)与白色生成物(MgO)的物质的量之比为1:4,故氧气过量,通过浓硫酸后的气体为CO2和O2的混合物,设Mg与O2、CO2反应分别生成MgO的物质的量为x、y:
2Mg+O2═2MgO 2Mg+CO2═2MgO+C.
0.5x x y 0.5y
$\left\{\begin{array}{l}40g•mo{l^{-1}}(x+y)+12g•mo{l^{-1}}×0.5y=5.16g\\ x+y=4×0.5y\end{array}\right.$
解得:x=y=0.06mol,过量的n(CO2)=0.03mol,生成的n(CO2)=0.03mol,生成的n(H2O)=$\frac{0.54g}{18g•mo{l}^{-1}}$=0.03mol,0.01molA的质量m(A)=[0.03×44+0.54-($\frac{1.456}{22.4}-0.03$)×32]g=0.74g,M(A)=$\frac{0.74g}{0.01mol}$=74g•mol-1
设A的分子式为C3H6Oz,有3×12+6×1+16z=74,z=2,A的分子式为C3H6O2,
答:A的分子式为C3H6O2.
点评 本题考查有机物的确定,题目难度不大,注意从质量守恒的角度计算二氧化碳的物质的量,再根据原子守恒计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤⑦ | D. | ①④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100 mL 1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL 2 mol•L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
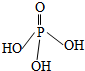 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na5P3O10 | |
| C. | 以磷酸钠为原料通过化合反应也能生成三聚磷酸钠 | |
| D. | 多聚磷酸的结构可表示为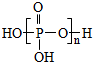 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
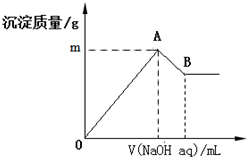 在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )
在含有0.06mol Cl-、0.07mol SO42-及一定量Mg2+和Al3+的混合溶液中,滴入2mol/L NaOH溶液,产生沉淀情况如图.若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x(不考虑Mg2+和Al3+水解及水的电离).则下列说法错误的是( )| A. | a的取值范围是0<a<$\frac{1}{15}$ | |
| B. | 图中m的取值范围5.2~5.8 | |
| C. | A、B两点横坐标的数值均随x变化而变化 | |
| D. | 若B点横坐标数值为120,则a=0.04 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com