
如下图所示,利用培养皿探究氨气的性质。

实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象 所做的解释正确的是
所做的解释正确的是
| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出的HCl反应产生了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |

科目:高中化学 来源: 题型:
某金属单质跟一定浓度的硝酸反应,假若只产生单一的还原产物,当参加反应的单质与被还原的硝酸的物质的量之比为2:1,则还原产物是 ( )
A.NO2 B.NO C.N2O D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于漂白粉的叙述正确的是
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱制得的
D.在使用漂白粉时应用浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
一氧化二氯(Cl2O)是黄棕色具有强烈刺激性气味的气体。它的熔点为-116 ℃,沸点是3.8 ℃。一氧化二氯不稳定,接触一般有机物易发生爆炸;它易溶于水且易与水反应形成次氯酸溶液。制备出一氧化二氯之后,要冷却为固态才便于操作和贮存,制取少量一氧化二氯,是用干燥的氧化汞与氯气反应(同时还生成HgO·HgCl2)。制备装置如下图所示,加热装置和夹持仪器已略去。

部分物质的有关资料如下:
| 化学式 | N2 | O2 | CO2 | NH3 | Cl2 |
| 熔点(℃) | -209.86 | -218.4 | -78.5(升华) | -77.3 | -101 |
| 沸点(℃) | -195.8 | -183 | -33.35 | -34.6 |
试回答:
(1)试说明加入试剂前检验A、B、C处仪器气密性的操作方法___________________
____________________________________________________________________。
(2)A中盛有的深色固体试剂a应是________,分液漏斗中的b试剂是________。
(3)B中盛有的液体c应是________________,C中的液体d是____________。
(4)D中发生反应的化学方程式是_______________________________________。
(5)E中的保温瓶中盛有液态致冷剂c,它应是________(在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)。在E的内管得到的Cl2O中可能含有的杂质主要是________。
(6)装置D、E间的连接方式与A、B、C间的连接方式有明显的差别,这区别是_____ ___________________________________________________________________,
___________________________________________________________________,
用这种不同的连接方式的主要理由是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于环境、健康及能源的叙述中,不正确的是
A.氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以他们的含量是空气质量报告的主要项目
B.严格讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收
C.开发利用新能源,合理利用工业生产的废热,是缓解能源危机的重要途径
D.用二氧化硫、亚硝酸钠、苏丹红等化学药品“美化”后的食物“味美、色艳”,但添加剂超标,对人体危害极大

查看答案和解析>>
科目:高中化学 来源: 题型:
现有0.1 mol由等物质的量组成的Fe、Cu合金,研成粉末后,全部投入稀硝酸中,微热使其充分反应,已知硝酸的还原产物只有NO。由于HNO3用量的不同,溶液中的金属离子和残留固体的成分会有多种情况。下列说法不正确的是
A.根据溶液中的金属离子和残留固体的成分最多会有6种情况
 B.若金属有剩余,在溶液中再滴入稀硫酸后,金属又开始溶解
B.若金属有剩余,在溶液中再滴入稀硫酸后,金属又开始溶解
C.当合金刚好溶解时,在标准状况下产生2.24 L NO
D.若合金全部溶解,在溶液中加入过量的氨水,经过滤、洗涤、干燥、充分灼烧、称量、得固体4 g

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,属于取代反应的是( )
①CH3CH===CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②2CH3CH2OH+O2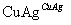 2CH3CHO+2H2O
2CH3CHO+2H2O
③CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
A.①② B.③④
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

请回答下列问题:
(1)环戊二烯分子中最多有________个原子共平面;
(2)金刚烷的分子式为________,其分子中的CH2基团有________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应 ①的产物名称是________,反应②的反应试剂和反应条件是________,反应③的反应类型是________;
①的产物名称是________,反应②的反应试剂和反应条件是________,反应③的反应类型是________;
(4)已知烯烃能发生如下反应: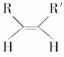
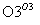
 RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式:
 ___________________________________________;
___________________________________________;
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环上的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基],写出A所有可能的结构简式(不考虑立体异构):
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ▲ ;
步骤③中反应的离子方程式为: ▲ 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
▲ (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com