
| 晶体 | NaCl | MgCl2 | AlCl3 | SiCl4 | 单质R |
| 熔点 | 810℃ | 710℃ | 180℃ | -70℃ | 2300℃ |
| 沸点 | 1465℃ | 1418℃ | 177.8℃ | 57℃ | 2500℃ |
| A. | AlCl3为离子晶体 | B. | MgCl2为离子晶体 | ||
| C. | SiCl4是分子晶体 | D. | 单质R可能是原子晶体 |
分析 晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,根据表中数据知,NaCl、MgCl2都属于离子晶体,AlCl3、SiCl4都属于分子晶体,R熔沸点较高,所以R可能属于原子晶体,据此分析解答.
解答 解:晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,根据表中数据知,NaCl、MgCl2都属于离子晶体,AlCl3、SiCl4都属于分子晶体,R熔沸点较高,所以R可能属于原子晶体,
A.氯化铝熔沸点较低,所以氯化铝为分子晶体,故A错误;
B.MgCl2晶体熔沸点越高,所以是离子晶体,故B正确;
C.SiCl4熔沸点较低,属于分子晶体,故C正确;
D.R熔沸点较高,所以R可能属于原子晶体,故D正确;
故选A.
点评 本题考查晶体与熔沸点关系,侧重考查学生分析判断能力,明确晶体熔沸点高低顺序是解本题关键,注意不能根据晶体中是否含有金属元素判断离子晶体,易错选项是A.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
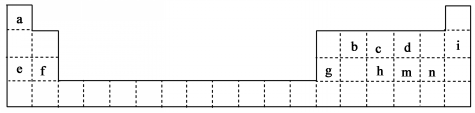
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+ Mg2+ Al3+ Ba2+Fe3+ |
| 阴离子 | OH- Cl- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ HSO${\;}_{4}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
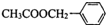 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下: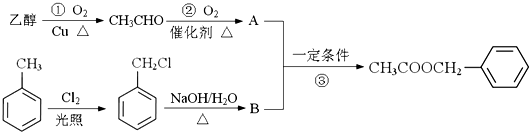
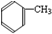 制备
制备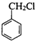 C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A
C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔中碳原子形成的是sp杂化轨道,因此易于发生加成反应和氧化反应 | |
| B. | 金属锂的摩尔质量小,因此锂电池具有比能量大的优点 | |
| C. | 苯环中含有大π键,因此易于发生加成反应,难于发生取代反应 | |
| D. | 相同温度、相同浓度的CH3COOH与NH3•H2O的电离能力相同,因此CH3COONH4溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 麦芽糖及其水解产物均能发生银镜反应 | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| D. | 将甘氨酸和丙氨酸混合后缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
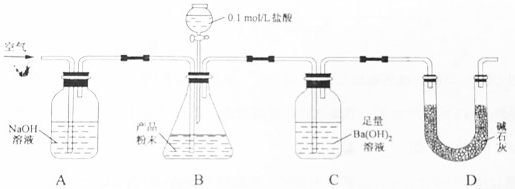
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com