
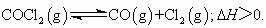 当反应达到平衡时,下列措施:①升温 ②恒压通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂 ,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒压通入惰性气体③增加CO的浓度 ④减压 ⑤加催化剂 ,能提高COCl2转化率的是
A.①④⑤ B.①②④ C.②③⑤ D.③④⑤
科目:高中化学 来源: 题型:
今有两种由C、H、O元素组成的化合物A和B.它们分子中C、H、O原子个数的最简单整数比相同,但B分子量比A分子量大.将0.264克A或B完全燃烧,都得到0.216克H2O和0.528克CO2.设有A和B的等摩尔的混和物0.165克,保持在127℃和1大气压时,其气态体积为82.0毫升.
(1)求A和B分子中C、H、O原子个数的最简单的整数比.
(2)求A和B的分子量和分子式.
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的水溶液,它的氧化产物甲和还原产物乙都能与金属钠反应放出H2,甲和乙反应生成丙,甲、丙均能发生银镜反应,这种有机物是( )
A、乙醛 B、甲酸
C、甲醛 D、甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
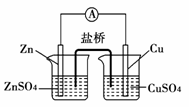
关于如图所示的原电池,下列说法错误的是
A.电子从锌电极通过电流计流向铜电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生氧化反应,铜电极发生还原反应
D.铜电极上发生的电极反应为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
A.CO2气体分解生成CO气和O2气体的反应是放热反应
B.CO气体与O2气体生成CO2气体的反应是放热反应
C.右图可表示由CO气体生成CO2气体的反应过
程和能量关系
D.在相同条件下,2 mol CO气体与1 mol O2气体的能量总和大于2 mol CO2气体的能量

查看答案和解析>>
科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01mol/L HCl溶液的PH= ;PH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”)。
(4)将等PH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m n (填“大于、等于、小于”)。
(5)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”)。
② K点对应的溶液中,c(M+)+c(MOH)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.质子数为53,中子数为78的碘原子:78 53I
B.乙烯的结构简式:CH2CH2
C.S2-的结构示意图: 
D.CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计及其对应的离子方程式均正确的是 ( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有氧化性:
2MnO4-+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用石灰石代替碱液处理酸性废水可降低成本。大多数情况下,利用石灰石处理含金属离子的酸性废水并不适用,原因在于酸与石灰石反应的限度,使溶液体系的pH不能达到6.0以上的排放标准。当酸性废水中含有Fe3+、Fe2+、Al3+时能利用石灰石处理该酸性废水,可使pH上升到6.0以上,达到满意效果,其研究步骤如下:
Ⅰ、向0.1mol/L 盐酸,加入石灰石粉,当溶液体系 pH 升至5.6 时, 再继续加入石灰石粉无气泡冒出,说明此时已达溶解平衡。
Ⅱ、向含Fe3+、Fe2+、Al3+的酸性废水中加入适量的0.1mol/L 盐酸和30% H2O2溶液,充分反应。
Ⅲ、将Ⅱ中获得的溶液加入到Ⅰ溶液中,得到混合液x,测得混合液pH<2.0。
Ⅳ、向混合液x中加入石灰石粉,有大量气体产生,并逐渐有沉淀生成。pH 升到 6.2时停止加石灰石粉。
(1)HCl的电子式是 。
(2)石灰石与盐酸反应的离子方程式是 。
(3)从化学平衡的角度分析CaCO3与盐酸反应的原理 (用化学用语表示)。
(4)CaCl2溶液显中性,步骤Ⅰ中溶液体系 pH = 5.6的原因是 。
(5)步骤Ⅱ中反应的离子方程式是 。
(6)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释步骤Ⅱ的目的: 。
(7)步骤Ⅳ中,当 pH 上升到 3.3 以上时,会促进Al3+的水解,Al3+水解的离子方程式是 。
(8)步骤Ⅳ中溶液体系的 pH 可上升到6.2,是因为生成Al(OH)3可与溶液中的HCO3-反应使c(CO32-)增大,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com