
H2O2、CH3COOH是生活中常见的物质,在化学研究中应用广泛.
(1)某小组拟在Fe3+的催化下,探究H2O2分解速率影响的某一因素.限选试剂与仪器:30% H2O2、0.1mol∙L﹣1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
将表中所给的混合溶液分别加入到2个同容积的锥形瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol∙L﹣1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
表中Vx= mL,实验目的是 .
(2)醋酸和盐酸是化学实验中常见的二种一元酸,某小组设计下列实验证明它们的电离程度.
实验一:室温下,测出0.1mol•L﹣1醋酸和盐酸pH值分别为3、1.提示:pH=﹣lgc(H+)
结论一:醋酸在水溶液中电离 (填“完全”、“不完全”).该温度下醋酸的电离度为 ;写出醋酸的电离方程式 .
实验二:现取等体积、浓度均为1mol•L﹣1醋酸和盐酸分别加入经砂纸打磨过的表面积相同的镁条.观察放出氢气速率的快慢.
结论二:其它条件相同时,同浓度同体积的一元酸与金属反应时,反应 (填“快”或“慢”)的为弱电解质.
考点:
探究影响化学反应速率的因素;弱电解质在水溶液中的电离平衡.
专题:
实验设计题.
分析:
(1)根据实验目的探究H2O2分解速率影响的某一因素,即保证其他条件要一样,由表格发现Fe2(SO4)3的量一样,要保证Fe2(SO4)3的浓度不变还需总体积不变,所以Vx应为5ml,这样2次对比实验只有双氧水的浓度不同;
(2)醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子,再结合PH值进行计算电离度;根据反应物的浓度影响速率的因素来判断.
解答:
解:(1)根据实验目的探究H2O2分解速率影响的某一因素,即保证其他条件要一样,由表格发现Fe2(SO4)3的量一样,要保证Fe2(SO4)3的浓度不变还需总体积不变,所以Vx应为5ml,这样2次对比实验只有双氧水的浓度不同,故答案为:5;探究H2O2的浓度对分解速率影响;
(2)醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH⇌H++CH3COO﹣,测出0.1mol•L﹣1醋酸pH值分别为3,则说明0.1mol•L﹣1醋酸中氢离子浓度为10﹣3mol•L﹣1故电离度为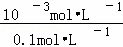 ×100%=1%,
×100%=1%,
根据氢离子浓度越大与金属反应时速率越快,可以判断反应慢的为弱电解质;
故答案为:不完全;1%;CH3COOH⇌H++CH3COO﹣;慢.
点评:
本题考查反应速率影响因素实验、弱电解质的电离等,侧重对学生综合能力的考查,需要学生具备扎实的基础,注意利用控制变量法测定外界条件对反应速率的影响,难度中等.


科目:高中化学 来源: 题型:
已知 4NH3(气)+5O2(气)=4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L•min]表示,则正确的关系是()
A. 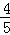 V(NH3)=V(O2) B.
V(NH3)=V(O2) B. 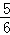 V(O2)=V(H2O) C.
V(O2)=V(H2O) C. 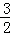 V(NH3)=V(H2O) D.
V(NH3)=V(H2O) D. 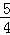 V(O2)=V(NO)
V(O2)=V(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
以石墨为电极,电解含有少量酚酞和淀粉的NaI溶液.已知:通常条件下,I﹣的放电能力比Cl﹣更强.下列说法错误的是()
A. 阴极附近溶液呈红色 B. 阴极逸出气体
C. 阳极附近溶液呈蓝色 D. 溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
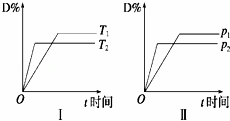
对于可逆反应mA(g)+nB(s)⇌pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是( )
|
| A. | 化学方程式中化学计量数:m>p+q |
|
| B. | 降温可使化学平衡向正反应方向移动 |
|
| C. | 使用合适的催化剂可使D%有所增加 |
|
| D. | B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
|
| A. | 未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
|
| B. | 电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
|
| C. | 未通电前K+向铁极移动,通电后K+还向铁极移动 |
|
| D. | 镀锌层破损后对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
-A.-同种胶体带同种电荷,相互排斥,是胶体稳定的主要原因
-B.-生石灰与水混合的过程只发生物理变化
-C.-O3是由3个氧原子构成的化合物
-D.-可用丁达尔效应区分溶液与胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
取100mL 0.3mol•L﹣1和300mL 0.25mol•L﹣1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中硫酸的物质的量浓度是( )
-A.-0.21mol•L﹣1-B.-0.42mol•L﹣1-C.-0.56mol•L﹣1-D.-0.26mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
检验某未知溶液中是否含有SO42﹣,下列操作最合理的是( )
|
| A. | 加入稀硝酸酸化的Ba(NO3)2溶液 |
|
| B. | 加入盐酸酸化的BaCl2溶液 |
|
| C. | 先加稀硝酸酸化,再加Ba(NO3)2溶液 |
|
| D. | 先加盐酸酸化,再加BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
配制250mL0.5mol/L的盐酸溶液,需4mol/L的盐酸的体积是( )
|
| A. | 25mL | B. | 31.3mL | C. | 12.5mL | D. | 100mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com