
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g) 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g) CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为__________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)__________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
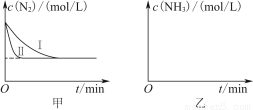
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
(1)AD
(2)-41.2 kJ·mol-1
(3)CH3OH(g)+H2O-6e-=CO2+6H+ 14
(4)K=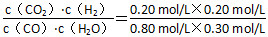 =0.17 3CO2+5OH-=2CO32—+HCO3—+2H2O
=0.17 3CO2+5OH-=2CO32—+HCO3—+2H2O
(5)①使用催化剂
②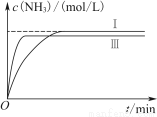
【解析】(1)该反应为吸热反应,升高温度,平衡向右移动,反应物平衡转化率升高,A项正确;增加固体反应物的量不会引起平衡的移动,B项错误;催化剂不能使平衡移动,C项错误;生成物浓度降低,平衡向正反应方向移动,反应物平衡转化率升高,D项正确。(2)根据盖斯定律,方程式C(s)+H2O(g) CO(g)+H2(g)与C(s)+CO2(g)??2CO(g)相减可得CO(g)+H2O(g)??CO2(g)+H2(g),则ΔH=+131.3 kJ·mol-1-172.5 kJ·mol-1=-41.2 kJ·mol-1。(3)电池总反应为2CH3OH+3O2=2CO2+4H2O,酸性条件下,正极反应为O2+4H++4e-=2H2O,总反应减去正极反应可得负极反应为CH3OH(g) +H2O-6e-=CO2 +6H+;0.01 mol CH3OH完全放电可提供0.06 mol电子,则电解NaCl溶液时电路中流过的电子为0.06 mol,生成OH-的物质的量为0.06 mol,溶液中c(OH-)=1 mol/L,pH=14。
CO(g)+H2(g)与C(s)+CO2(g)??2CO(g)相减可得CO(g)+H2O(g)??CO2(g)+H2(g),则ΔH=+131.3 kJ·mol-1-172.5 kJ·mol-1=-41.2 kJ·mol-1。(3)电池总反应为2CH3OH+3O2=2CO2+4H2O,酸性条件下,正极反应为O2+4H++4e-=2H2O,总反应减去正极反应可得负极反应为CH3OH(g) +H2O-6e-=CO2 +6H+;0.01 mol CH3OH完全放电可提供0.06 mol电子,则电解NaCl溶液时电路中流过的电子为0.06 mol,生成OH-的物质的量为0.06 mol,溶液中c(OH-)=1 mol/L,pH=14。
(4)由题目所给数据可知:
CO(g) + H2O(l)??CO2(g) + H2(g)
起始量 2.0 mol 1.0 mol 0 0
转化的量 0.4 mol 0.4 mol 0.4 mol 0.4 mol
平衡量 1.6 mol 0.6 mol 0.4 mol 0.4 mol
平衡浓度 0.8 mol/L 0.3 mol/L 0.2 mol/L 0.2 mol/L
则K=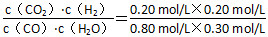 ≈0.17;由题意可知,CO2和NaOH的物质的量之比为3∶5,可知产物中CO32—和HCO3—共存。(5)①与实验Ⅰ比较,实验Ⅱ中反应速率加快且反应物平衡转化率没有改变,故改变的条件为使用了催化剂;②温度升高,达到平衡的时间缩短,则在曲线中早到达拐点;该反应为放热反应,升高温度,平衡向逆反应方向移动,故生成物浓度降低
≈0.17;由题意可知,CO2和NaOH的物质的量之比为3∶5,可知产物中CO32—和HCO3—共存。(5)①与实验Ⅰ比较,实验Ⅱ中反应速率加快且反应物平衡转化率没有改变,故改变的条件为使用了催化剂;②温度升高,达到平衡的时间缩短,则在曲线中早到达拐点;该反应为放热反应,升高温度,平衡向逆反应方向移动,故生成物浓度降低


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)∶n(CuSO4)=1∶9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是( )
A.a电极与电源的负极相连
B.t2时,两电极的质量相差3.84 g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:实验题
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
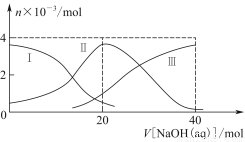
A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A=HA-+H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列有关说法正确的是( )
A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7
B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
C.pH=6的纯水中,c(OH-)=10-8 mol·L-1
D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
A.物质A、B的转化率之比为a∶b
B.当v正(A)=2v逆(B)时,可确定反应到达平衡状态
C.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b—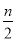 )
)
D.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
已知(CH3COOH)2(g) 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量(
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量( )随温度(T)的变化曲线如图所示,下列说法正确的是( )
)随温度(T)的变化曲线如图所示,下列说法正确的是( )
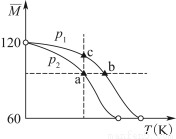
A.该过程的ΔH<0
B.气体压强:p(a)<p(b)=p(c)
C.平衡常数:K(a)=K(b)<K(c)
D.测定乙酸的相对分子质量要在高压、低温条件
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是________(填字母)。
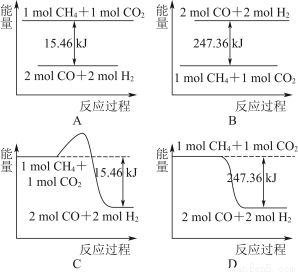
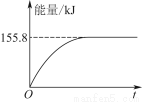
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出,C(s)+2H2(g)=CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
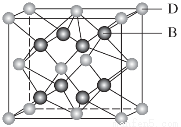
有A、B、C、D、E、F 6种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有3个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。
请回答下列问题:
(1)E元素原子基态时的电子排布式为________________________________________________________________________。
(2)F的氧化物FO3分子的空间构型为________。
(3)CA3极易溶于水,其原因主要是________________________________________________________________________。
与其最简单分子互为等电子体的阳离子为________。
(4)下列分子结构图中的“ ”表示相关元素的原子中除去最外层电子的剩余部分,“
”表示相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
”表示没有形成共价键的最外层电子,短线表示共价键。
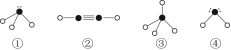
则在以上分子中,中心原子采用sp3杂化形成化学键的是________(填写序号);在②的分子中有________个σ键和________个π键。
(5)从图中可以看出,D与B形成的离子化合物的化学式为________。
(6)图中,若D与B的离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________________________________________________________________(写出表达式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com