
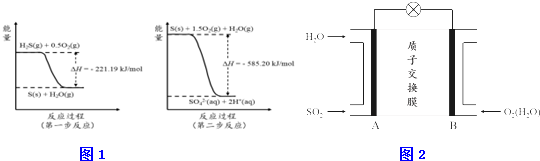
分析 (1)二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律计算反应热;
(3)原电池中阳离子移向正极,依据二氧化硫、氧气发生反应判断电极,判断质子移动方向.
解答 解:(1)二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2O?H2SO3;H2SO3?H++HSO3-;故答案为:SO2+H2O?H2SO3;H2SO3?H++HSO3-;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJ•mol-1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJ•mol-1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1;
故答案为:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJ•mol-1;
(3)二氧化硫发生氧化反应,氧气发生还原反应,所以二氧化硫所在电极为负极,氧气所在电极为正极,原电池中阳离子移向正极,所以质子移动方向为:从A到B;
故答案为:从A到B.
点评 本题为综合题,考查了离子方程式、热化学方程式的计算、盖斯定律计算反应热书写,明确二氧化硫的性质及离子方程式、热化学方程式书写方法、原电池工作原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
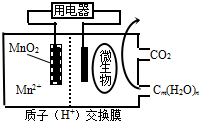
| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为-283 kJ•mol-1 | |
| B. | CO的燃烧热为566 kJ•mol-1 | |
| C. | CO的燃烧热△H=-283 kJ•mol-1 | |
| D. | 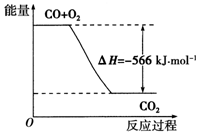 如图可表示由CO生成CO2的反应过程和能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中由水电离出c(H+)都是1.0×10-12 mol•L-1 | |
| B. | NaOH溶液和盐酸中由水电离出c(OH-)分别为1.0×10-2mol•L-1、1.0×10-12 mol•L-1 | |
| C. | 两溶液中由水电离出的c(H+)相等 | |
| D. | 两者都促进了水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2LN2中含电子总数为5NA | |
| B. | 标准状况下,22.4LN2H4中所含原子总数为6NA | |
| C. | 标准状况下,3.2gN2H4中含有共价键的总数为0.6NA | |
| D. | 若生成3.6gH2O,则上述反应转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混凝法,用明矾做混凝剂:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 中和法,用过量CO2中和碱性废水:CO2+2OH-═CO32- | |
| C. | 沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ | |
| D. | 氧化还原法,用FeSO4将酸性废水中Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com