
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
分析 A、氯气和铁反应后变为-1价;
B、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子来分析;
C、求出铵根离子的物质的量,然后根据铵根离子中含11个质子来分析;
D、标况下水为液态.
解答 解:A、氯气和铁反应后变为-1价,故1mol氯气和铁反应后转移2mol电子即2NA个,故A错误;
B、溶液中碳酸钠的物质的量n=CV=2mol/L×0.5L=1mol,而1mol碳酸钠中含2mol钠离子,即2NA个,故B正确;
C、1.8g铵根离子的物质的量为0.1mol,而铵根离子中含11个质子,故0.1mol铵根离子中含1.1NA个质子,故C错误;
D、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论或原因 | |
| A | SO2的水溶液可以导电 | SO2是电解质 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的Ca(ClO)2与空气中的CO2反应生成CaCO3和见光易分解的HClO |
| C | 石灰石与二氧化硅在高温下反应可制得硅酸钙 | 非金属性:Si>C |
| D | 碳酸氢钠可用作食品的膨松剂 | 碳酸氢钠能与碱反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
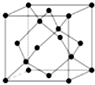 A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题:
A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、NaHCO3均可能与强酸、强碱反应,都为两性物质 | |
| B. | Na2CO3、CH3COOH、Cu2(OH)2CO3均含有碳元素,都是有机化合物 | |
| C. | BaCO3、BaSO3、BaSO4均难溶于水,均属于难溶电解质 | |
| D. | HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=C(CH3)-CH=CH2 2-甲基-1,3-二丁烯 | |
| B. | 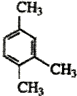 1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2C≡CCH2 CH (CH3)2 6-甲基-3-庚炔 | |
| D. | 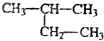 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,4.48LCHCl3的分子数为0.2 NA | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
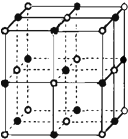 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com