
| A�� | 98.3%��������뵽ϡ����������Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol | |
| B�� | ��NH4Fe��SO4��2��Һ����μ���Ba��OH��2��Һ�����ܷ����ķ�Ӧ�ǣ�3NH4++Fe3++3SO42-+3Ba2++6OH-�T3BaSO4��+Fe��OH��3��+3NH3•H2O | |
| C�� | �ữ�ĵ��۵⻯����Һ�ڿ����б�����4I-+O2+4H+�T2I2+2H2O | |
| D�� | Na2SO3��Һʹ����KMnO4��Һ��ɫ��5SO32-+6H++2MnO4-�T5SO42-+2Mn2++3H2O |
���� A.98.3%������ΪŨ���ᣬ������������Ӧ�ų���������ϡ����������������Ӧ�ų��������ࣻ
B����μ���Ba��OH��2��Һ������������ȫ��Ӧ����1��2ʱ笠����Ӳμӷ�Ӧ��
C������������ԭ��Ӧ����ѭ���ӡ�����غ㣻
D������������ԭ��Ӧ����ѭ���ӡ�����غ㣮
��� �⣺A.98.3%��������뵽ϡ����������Һ���ų��������࣬��������H+��aq��+OH-��aq���TH2O��l����H=-57.3kJ/mol��ʾ����A����
B����笠����ӷ�Ӧ�����ܷ����ķ�Ӧ�ǣ�NH4++Fe3++2SO42-+2Ba2++4OH-�T2BaSO4��+Fe��OH��3��+NH3•H2O����B����
C���ữ�ĵ��۵⻯����Һ�ڿ����б��������ӷ�ӦΪ4I-+O2+4H+�T2I2+2H2O����C��ȷ��
D��Na2SO3��Һʹ����KMnO4��Һ��ɫ�����ӷ�ӦΪ5SO32-+6H++2MnO4-�T5SO42-+2Mn2++3H2O����D��ȷ��
��ѡCD��
���� ���⿼�����ӷ�Ӧ����ʽ��д�������жϣ�Ϊ��Ƶ���㣬���շ����ķ�Ӧ�����ӷ�Ӧ����д����Ϊ���Ĺؼ�������������ԭ��Ӧ�������йط�Ӧ�����ӷ�Ӧ���飬ע��ѡ��A�к��ȵ��жϣ���Ŀ�ѶȲ���


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.6L | B�� | 11.2L | C�� | 2.24L | D�� | 4.48L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������һ���Ǽ��������� | |
| B�� | �����������ɢϵ�ı��������Ƿ�ɢ�����Ӵ�С��ͬ | |
| C�� | ��ʯ�ҡ����ᡢ����Ȼ��ƶ�Ӧ�����������������ᡢ��� | |
| D�� | ����������һ���Ƿǽ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ȼ�����Һ�м������ۣ�Fe3++Fe�T2Fe2+ | |
| B�� | ��������Һ��ͨ������CO2��CO2+H2O+C6H5O-��C6H5OH+HCO3- | |
| C�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� | |
| D�� | ��Ũ������MnO2��Ӧ��ȡ����������MnO2+4H++4Cl-�TMn2++Cl2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
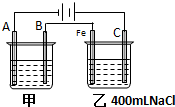 ��ͼΪ������ļס����������Իش�
��ͼΪ������ļס����������Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MgSO4 ��Һ��Ba��OH��2��Һ��Ӧ��SO42-+Ba2+�TBa SO4�� | |
| B�� | ����ˮ�ķ�Ӧ��2Na+2H2O�T2Na++2OH-+H2�� | |
| C�� | ��Ƭ������������Һ��Ӧ��2Al+2OH--+2H2O�TAlO2-+3H2�� | |
| D�� | �������������������Fe��OH��3+3H+�TFe3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ⱥ�μ���ɫʯ����Һ��BaCl2��Һ�����Խ����ᡢ���ᡢ�����ơ��������ƺ������������ɫ��Һ���� | |
| B�� | �ü������CuCl2��Һ���ٹ��ˣ���ȥCu��NO3��2��Һ�л��е�AgNO3 | |
| C�� | ��ij��ɫδ֪��Һ�н�����BaCl2��Һ���Լ���δ֪��Һ�е�SO42- | |
| D�� | ij�����ڼ���ϡ�����������ɫ��ζ����ʹ����ʯ��ˮ����ǵ����壬֤���ù���һ������CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �٢ۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/s | 0 | 50 | 100 |
| c��N2O5��/mol•L-1 | 5.0 | 3.5 | 2.4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com