
分析 (1)氯化铵溶液中铵根离子水解,结合水电离出的氢氧根离子促进水电离平衡正向进行,溶液显酸性;
(2)碳酸氢钠是强碱弱酸盐,溶液中碳酸氢根离子为弱酸的酸式根离子水解生成碳酸和氢氧根离子;
(3)FeCl3是强酸弱碱盐,铁离子水解而使其溶液呈酸性;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧Fe(OH)3时,Fe(OH)3会分解生成氧化铁和水,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体.
解答 解:(1)氯化铵溶液中铵根离子水解,结合水电离出的氢氧根离子促进水电离平衡正向进行,溶液显酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)NaHCO3溶液呈碱性原因是碳酸氢根离子水解生成氢氧根离子,离子方程式:HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(3)FeCl3是强酸弱碱盐,铁离子水解生成Fe(OH)3和HCl而使其溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;将FeCl3溶液蒸干时,铁离子水解生成Fe(OH)3和HCl,升高温度促进HCl挥发,所以蒸干溶液时得到碱,灼烧氢氧化铁时,氢氧化铁会分解,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的是红棕色固体Fe2O3,若把NaHCO3溶液和FeCl3溶液混合发生双水解反应生成氢氧化铁红褐色沉淀和二氧化碳气体,反应的离子方程式为:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
+H2O,
故答案为:酸;Fe3++3H2O?Fe(OH)3+3H+,Fe2O3,Fe3++3HCO3-=Fe(OH)3↓+3CO2↑+H2O.
点评 本题考查了盐类水解、离子方程式的书写,明确盐的类型即可判断盐溶液酸碱性,蒸干盐溶液时,如果生成难挥发性酸和强碱,蒸干时得到盐本身,如果水解生成挥发性酸和碱,蒸干时得到碱,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水制取氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱 | |
| B. | 黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 | |
| C. | 过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁 | |
| D. | “固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
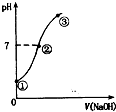 常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )
常温下,向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是( )| A. | ①点所示溶液中只存在HCl0的电离平衡 | |
| B. | ②到③的过程中水的电离程度一定减少 | |
| C. | ②点处表示氯气与氢氧化钠溶液恰好反应完全 | |
| D. | ②点所示溶液中:c( Na+)=c(HCl0)+2c(ClO -) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种粒子中含有3个质子 | B. | 它的组成可用H3表示 | ||
| C. | 这种粒子中含有3个中子 | D. | 是氢的一种新的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和Cu2O的物质的量之比为2:1 | |
| B. | 产生的NO在标准状况下的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol•L-1 | |
| D. | Cu和Cu2O与硝酸反应后剩余HNO3为0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com