
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。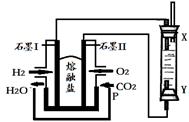
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
(1)2Fe3+ + Cu  2Fe2+ + Cu2+ (2分)
2Fe2+ + Cu2+ (2分)
(2)-11 kJ·mol-1 (2分)
(3)11.2 g (2分)
(4)①H2 - 2e-+ CO32- CO2+H2O(2分)
CO2+H2O(2分)
②B C (2分)
③白色沉淀迅速变成灰绿色,最终变成红褐色(2分)
4Fe (OH)2+O2+2H2O=4Fe (OH)3 (2分)
解析试题分析:(1)氯化铁与铜反应生成氯化亚铁与氯化铁,离子方程式为2Fe3+ + Cu  2Fe2+ + Cu2+ ;
2Fe2+ + Cu2+ ;
(2)a、Fe(s)+ O2(g)═FeO(s)△H=-272 kJ·mol-1
O2(g)═FeO(s)△H=-272 kJ·mol-1
b、C(s)+O2(g)═CO2(g)△H=-393.5 kJ·mol-1
c、2C(s)+O2(g)═2CO(g)△H=-22l kJ·mol-1
依据盖斯定律b-c÷2-a得到:FeO(s)+CO(g) Fe(s)+CO2(g)△H=-1lkJ·mol-1;
Fe(s)+CO2(g)△H=-1lkJ·mol-1;
(3)氢气的物质的量为 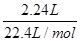 =0.1mol,
=0.1mol,
Fe ~ 2HCl ~ H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为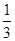 ×(0.16L×5mol·L-1-0.2mol)=0.2mol,
×(0.16L×5mol·L-1-0.2mol)=0.2mol,
Fe ~ 2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g·mol-1=11.2g,
(4)①燃料原电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为H2 - 2e-+ CO32- CO2+H2O;
CO2+H2O;
②电解法制备Fe (OH)2时,采用金属Fe作阳极,阳极方程式为:Fe-2e-=Fe2+;阴极材料可以是铁也可以是其他材料,阴极方程式为:2H++2e-=H2↑,因为氢离子放电破坏水的电离平衡,使氢氧根离子浓度增大,与亚铁离子结合成Fe (OH)2沉淀。
③因为在空气中Fe (OH)2容易发生以下反应:4Fe (OH)2+O2+2H2O=4Fe (OH)3(红褐色),所以沉淀中若有Fe (OH)2生成,暴露在空气中白色沉淀迅速变成灰绿色,最终变成红褐色。
考点:考查铁的综合化学知识。


科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。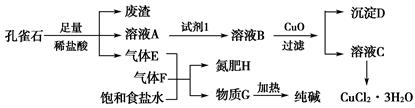
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
 Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把2.0 mol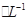 CuSO4和1.0 mol
CuSO4和1.0 mol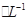 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
(1)混合溶液中CuSO4和H2SO4的物质的量浓度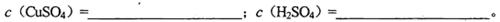
(2)混合液中和的物质的量浓度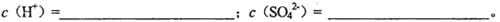
(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有一瓶存放时间较长的硫酸亚铁,外观上并无明显变化,但某学生怀疑其有部分因氧化而变质,请你设计1个检验硫酸亚铁是否变质的实验方案: 。如果有变质,当配制硫酸亚铁溶液时,应如何除去变质的杂质? 。
(2)FeCl3溶液棕黄色,对此溶液,分别做如下实验,请填表:
| 编号 | 实践操作 | 实验主要现象 | 离子方程式 |
| ① | 加入过量铁粉 | | |
| ② | 加入少量Na2O2粉末 | | |
| ③ | 加入少量AgNO3溶液 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业生产纯碱的工艺流程示意图如下: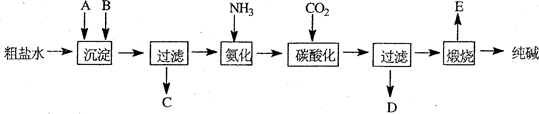
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A 、B 。
(2)碳酸化后发生反应的化学方程式是 。
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 。
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱。反应的化学方程式为_________ __ (已知产物之一为CaS);
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知有以下物质相互转化
试回答:(1)写出E的化学式 ,H的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)检验G溶液中的金属阳离子的方法是: ;
向G溶液加入A的有关离子反应方程式 。
(4)写出A在一定条件下与水反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。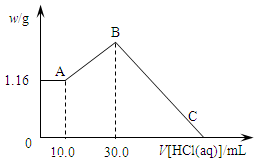
(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物: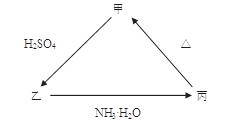
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液, 写出下列转化的方程式:
乙 丙的离子方程式______________________; 丙
丙的离子方程式______________________; 丙 甲的化学方程式____________________。
甲的化学方程式____________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。 甲 乙的离子方程式是_____________________________。
乙的离子方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上,将黄铜矿(CuFeS2)通过8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
(1)上述反应中,还原剂为 。
(2)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了 (写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
(3)对上述炉渣中进行含铁量的测定步骤如下: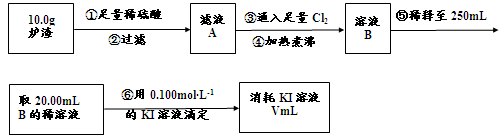
I.步骤③发生反应的离子方程式为 。
II.步骤④中煮沸的作用是 。
III.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
IV.若滴定过程中消耗0.100mol·L?1KI溶液20.00mL,则炉渣中铁的百分含量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com