
【题目】四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
字母代号 | X | Y | Z | W |
结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)W在元素周期表中的位置为_________。
(2)四种元素的最高价氧化物对应的水化物中,有一种物质与其他三种物质在一定条件下均能发生化学反应,该元素是_____(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为____(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为______________。
(5)下列可用来判断Z和Mg的金属性强弱的方法是_____(填序号)。
a.测量两种元素单质的硬度和熔、沸点
b.比较单质与同浓度盐酸反应的剧烈程度
c.比较两种元素在化合物中化合价的高低
【答案】第三周期ⅣA族 钠 NH4NO3 Al3++4OH===![]() +2H2O b
+2H2O b
【解析】
四种短周期元素X、Y、Z、W,原子序数依次增大,X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐,则X为N元素;Y焰色反应呈黄色,则Y为Na;Z、W原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Z的离子半径最小,则Z为Al,W原子核外最外层电子数是次外层电子数的一半,最外层电子数为4,则W为Si元素,据此解答。
四种短周期元素X、Y、Z、W,原子序数依次增大,X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐,则X为N元素;Y焰色反应呈黄色,则Y为Na;Z、W原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Z的离子半径最小,则Z为Al,W原子核外最外层电子数是次外层电子数的一半,最外层电子数为4,则W为Si元素。
(1)W为Si元素,处于周期表中第三周期ⅣA族;
(2)上述元素的最高价氧化物对应的水化物中,有一种物质与其它三种物质在一定条件下均能发生化学反应,该物质为NaOH,则对应的元素为钠;
(3)X元素的最高价氧化物对应的水化物HNO3与其气态氢化物MH3反应得到的化合物为NH4NO3;
(4)向含有铝离子的溶液中加入过量的NaOH溶液,反应离子方程式为:Al3++4OH===![]() +2H2O;
+2H2O;
(5)a.元素单质的硬度和熔、沸点不作为判断金属的金属性强弱,故a错误;
b.单质与盐酸反应的剧烈程度大的金属性强,可用来判断铝与镁的金属性强弱,故b正确;
c.金属性强弱与化合价高低无关(即与失去电子数多少无关),与难易程度有关,故c错误;
答案选b。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种元素,它们原子的核电荷数均小于18,且依次递增,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等;D的最外层电子数是次外层电子数的3倍;E的单质是用途最广泛的半导体材料。试推断它们各是什么元素并回答下列问题:
(1)写出它们的元素符号:A________,B________,C________,D________,E________。
(2)B、C、D的气态氢化物的稳定性由大到小的顺序为__________(用化学式表示)
(3)画出D的离子结构示意图________。
(4)用一个方程式证明B、E的非金属性的强弱_______________。
(5)写出E的最高价氧化物的一种用途:_________。
(6)由这五种元素组成的三核10电子的分子为________,四核10电子的分子是________。由这五种元素组成的四核18电子的分子为________,五核18电子的分子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
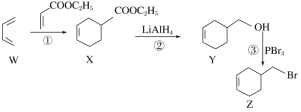
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。
(1)由第二周期元素组成,与F2互为等电子体的离子是____,与C2O42-互为等电子体的分子是____。
(2)Mn原子在元素周期表中的位置是____,价电子排布为____。
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。该离子的结构式为____,已知NF3与NH3的立体构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的常见化合价与原子序数的关系:
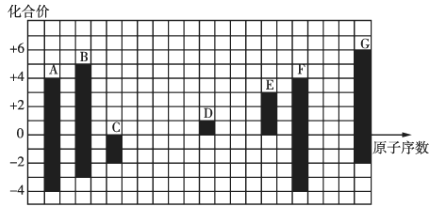
(1)元素![]() 在元素周期表中的位置是__________________。
在元素周期表中的位置是__________________。
(2)其中金属性最强的元素是______(用元素符号表示,下同),非金属性最强的元素是______。
(3)![]() 、
、![]() 、
、![]() 的半径由大到小的顺序是__________(用离子符号表示)。
的半径由大到小的顺序是__________(用离子符号表示)。
(4)最简单氢化物的稳定性:![]() ______
______![]() (填“
(填“![]() ”或“
”或“![]() ”)。
”)。
(5)![]() 、
、![]() 、
、![]() 元素最高价氧化物对应水化物的酸性:_____(用化学式表示,下同)
元素最高价氧化物对应水化物的酸性:_____(用化学式表示,下同)![]() ______
______![]() ______。
______。
(6)![]() 与
与![]() 形成的具有强氧化性的化合物为______(填化学式),该化合物与
形成的具有强氧化性的化合物为______(填化学式),该化合物与![]() 反应的化学方程式为________________________,其中氧化剂与还原剂的物质的量之比为____________。
反应的化学方程式为________________________,其中氧化剂与还原剂的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时使NH4HCO3分解,将所产生的气体依次通过Na2O2和浓H2SO4,则Na2O2增重ag,浓H2SO4增重bg;若将上述气体先通过浓H2SO4,则使酸液增重dg,再通过Na2O2,则使之增重cg。设气体皆完全被吸收,a、b、c、d质量由大到小的排列顺序正确的是
A.d a c bB.b c a dC.a c b dD.d c b a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将表面被氧化为Na2O、Na2O2的金属钠1.1g投入水中,收集到224mL气体(标准状况),该气体引爆后,冷却到原状态时,剩余气体为56mL。则Na、Na2O、Na2O2的质量分别为_____________克?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用NaCl为原料制备高氯酸,实验按流程如下所示:

下列说法不正确的是( )
A.电解Ⅰ分别用不锈钢网和石墨作电极,石墨电极上有黄绿色气体生成
B.“60℃歧化”的反应为:3Cl2+3CO32-=5Cl+ClO3-+3CO2
C.电解Ⅱ中阳极反应式为:ClO3-+2OH-2e=ClO4-+H2O
D.循环利用物质A的成分是NaCl、NaClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com