

| ||
| ||
| 1mol×28g/mol |
| 4g |
| 1 |
| 2 |
| 1 |
| 2 |
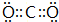 ,故答案为:
,故答案为: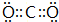 .
.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某蓄电池反应为NiO2+Fe+2H2O
某蓄电池反应为NiO2+Fe+2H2O| 放电 |
| 充电 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入足量Na2CO3溶液 |
| 操作甲 |
| 加入足量A |
| 加热 |
| 趁热过滤 |
| 结晶操作 |
| 控制酸度 |
| FeSO4?7H2O |
| 晶体 |
| 温度/ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/ | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | |||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
| B、向氯化铝溶液中加入足量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
| C、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| D、少量CO2气体通入苯酚钠溶液中:C6H5O-+CO2+H2O=C6H5OH+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com